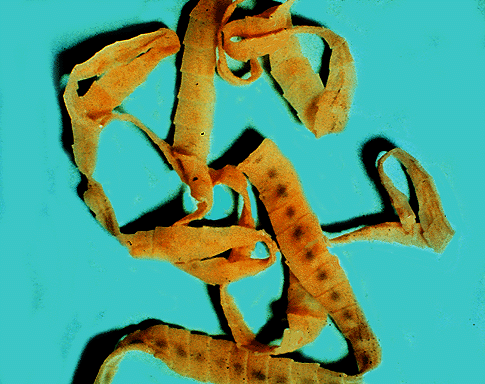Etiología
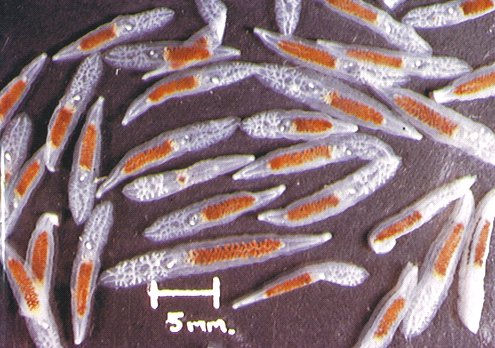
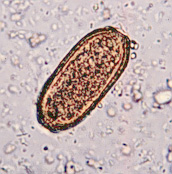
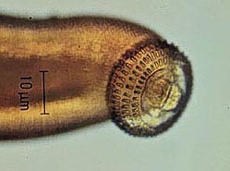
Las especies de nematodos anisákidos implicadas en los casos humanos pertenecen al orden Ascaridida y a la subfamilia Anisakinae (fig. 1). Anisakis simplex, la especie que tiene más interés por su amplia distribución y frecuencia en los pescados de consumo habitual, parasita cetáceos y pinnípedos; y aunque cosmopolita, es más frecuente en aguas frías y polares.
Fig. 1: Especies de anisákidos presentes en pescado desembarcado en España: Pseudoterranova decipiens (izquierda), Anisakis simplex (derecha-abajo) y Contracaecum osculatum (derecha-arriba). 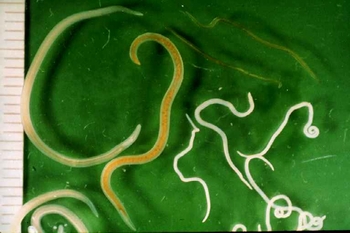
Otras especies descritas del mismo género son A. typica, A. physeteris y A. insignis. Pseudoterranova decipiens, llamado "el gusano del bacalao", parasita pinnípedos y se distribuye por aguas ártico-boreales, boreales y antárticas. Dentro de la morfoespecie P. decipiens se han descrito P. decipiens (sensu stricto), P. krabbei, P. bulbosa y P. azarasi. La especie menos frecuentemente implicada en la zoonosis humana es Contracaecum osculatum que parasita pinnípedos en el Hemisferio Norte. Otras especies descritas de este género son C. ogmorhini, C. turgidum, C. radiatum y C. mirounga.
Biología
Fig. 2: Ciclo biológico de los nematodos anisákidos. 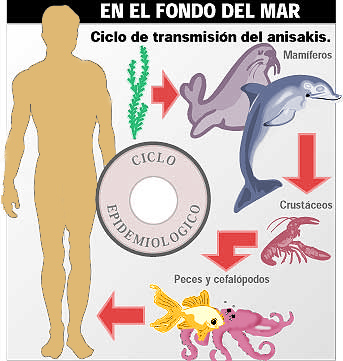
Los anisákidos adultos viven embebidos en la mucosa del estómago de numerosos mamíferos marinos (cetáceos odontocetos y pinnípedos). Las hembras parásitas producen huevos que alcanzan el ambiente marino con las heces del hospedador. Una vez embrionados, eclosionan larvas que para proseguir su desarrollo deben ser ingeridas por crustáceos eufáusidos, en cuyo hemocele se forman larvas de tercer estado infectantes para los hospedadores definitivos. Sin embargo, normalmente los crustáceos son ingeridos por peces y calamares que actúan como hospedadores paraténicos. Se permite así la distribución temporal y espacial del parásito, puesto que se ha demostrado la transferencia de las larvas de estos nematodos de unos peces a otros siguiendo ciclos de predación. Los mamíferos marinos se infectarán al ingerir peces y calamares parasitados. El hombre se infecta al ingerir accidentalmente larvas de anisákidos en platos realizados con pescado crudo o poco cocinado (fig. 2).
Peces hospedadores
Es difícil estudiar la epidemiología de la anisakiosis, fundamentalmente por lo complicado que es realizar muestreos adecuados en las diferentes poblaciones de hospedadores. Algunos trabajos demuestran que la prevalencia e intensidad de las infecciones por larvas de anisákidos pueden variar en una misma zona y en la misma especie hospedadora a lo largo del tiempo. Sin embargo, y a pesar de que no se conoce la importancia real de cada especie de pescado en la transmisión de los parásitos, debido a su importancia médica se han realizado numerosos estudios para determinar las especies de peces parasitadas con más frecuencia.
Las larvas se han encontrado en peces teleósteos y cefalópodos de todo el mundo y, por tanto, todos ellos deben considerarse como fuente de infección para el humano (tabla 2). Otros estudios demuestran también la infección de peces anadromos, como los salmónidos, que probablemente adquirieron la infección durante su permanencia en el mar e incluso de truchas cultivadas y otros peces de agua dulce, probablemente alimentados con desechos o cebos de peces marinos parasitados.
Tabla 2. Principales pescados comestibles portadores de larvas de anisákidos.
Gadiformes Merlucciidae Merluza, pescadilla (Merluccius spp.) Gadidae Bacalao (Gadus morhua), merlán, liba, bacalada (Merlangius merlangius), bacaladilla (Micromesistius poutassou), abadejo (Pollachius pollachius), carbonero (Pollachius virens), faneca (Trisopterus luscus), capellán (Trisopterus minutus capelanus), brótola (Phycis spp.), maruca (Molva molva), bertorella (Molva blennoides), palo (Molva dipterygia) Perciformes Scombridae Caballa, verdel (Scomber scombrus) Serranidae Cabra (Serranus cabrilla), serrano (Serranus scriba) Mullidae Salmonete de fango (Mullus barbatus), salmonete de roca (Mullus surmuletus) Sparidae Besugo (Pagellus cantabricus), pargo (Sparus pagrus), boga de mar (Boops boops) Thunnidae Atún (Thunnus thynnus), melva (Auxis thazard) Carangidae Jurel, chicharro (Trachurus trachurus), palometa blanca (Trachynotus glaucus) Bramidae Palometa, japuta, besugo negro (Brama brama) Trichiuridae Pez sable (Trichiurus lepturus) Clupeiformes Salmonidae Salmón (Salmo salar) Clupeidae Sardina (Sardina pilchardus), arenque (Clupea harengus) Engraulidae Boquerón (Engraulis encrasicholus) Pleuronectiformes Pleuronectidae Platija (Platichthys flessus), solla de altura (Pleuronectes platessa), fletán (Hippoglossoides spp.) Soleidae Lenguado (Solea vulgaris) Scophtalmidae Rodaballo (Scophthalmus maximus), gallo (Lepidorhombus spp.) Escorpeniformes Scorpaenidae Gallineta (Helicolenus dactylopterus), cabracho (Scorpaena scrofa) Triglidae Rubio (Trigloporus lastoviza) Bericiformes Berycidae Palometa roja (Beryx decadactylus) Lophiiformes Lophiidae Rape (Lophius piscatorius) Anguilliformes Congridae Congrio (Conger conger) Dibranchia Loliginidae Calamar (Loligo vulgaris) Octopodidae Pulpo (Octopus vulgaris) Sepiidae Sepia (Seppia spp.) En Japón, donde se diagnostican más 1.000 casos anuales de anisakiosis humana, se han encontrado larvas de estos parásitos en más de cien especies de peces que los japoneses gustan comer crudos. La cocina tradicional nipona incluye platos como el "sashimi" (filetes de pescado o calamar crudos aderezados con shoyu y wasabi), "sunomono" (filetes de pescado o calamar escabechados con vinagre) y el "isushi" (arroz con filetes de salmón o bacalao escabechados con vinagre), cuyo consumo mantiene la incidencia de la infección humana.
En España se han realizado también trabajos para determinar la frecuencia de parasitación de los peces de mayor consumo (tabla 3). Los diferentes muestreos realizados por Pereira-Bueno et al. (1989), Cuellar et al. (1991), Ruíz-Valero et al. (1991), Sanmartín et al. (1994), López Giménez y Castell-Monsalve (1994), Adroher et al. (1996), Viu et al. (1996), Pereira Bueno y Ferre (1997), de la Torre Molina et al. (2000) y Herreras et al. (2000), entre otros, demuestran que numerosos grupos de peces pueden albergar las larvas de estos ascáridos, como los Gadiformes, Clupeiformes, Bericiformes, Perciformes, Pleuronectiformes, Escorpeniformes, Lophiiformes y Anguilliformes, de los cuales, se han hallado larvas de anisákidos en más de 35 especies de consumo en nuestro país (tabla 2).
Tabla 3. Presencia de larvas de anisákidos en algunos peces de consumo habitual en España.
Referencia Merluza
(Merluccius merluccius)Bacaladilla
(Micromesistius poutassou)Jurel
(Trachurus trachurus)Boquerón
(Engraulis encrasicholus)Sardina
(Sardina pilchardus)Pereira Bueno et al. (1989) 45,4% 88,1% 54,3% 2,1% 0 Cuellar et al. (1991) 88,6% 30,3% 19,8% 0 0 Ruíz Valero et al. (1991) - 72,3% 27,5% - 0,9% Sanmartín et al. (1994) - 63-70% 44-67% - 10% López Giménez y Castell Monsalve (1994) 23,2% - 42,1% - - Viu et al. (1996) 71,5% 85,5% 60% 0 0 Adroher et al. (1996) - - 39,4% - - de la Torre Molina et al. (2000) 27,5% 42% - 5,6% - Las larvas de los anisákidos se encuentran enrolladas en espiral plana y encapsuladas en cualquier órgano de la cavidad corporal (especialmente en el hígado y mesenterio que rodea al intestino) y en la musculatura de los peces infectados (figs. 3 y 4).
Fig. 3: Larvas de Anisakis simplex enquistadas en espiral plana en el hígado de una bacaladilla (Micromesistius poutassou). 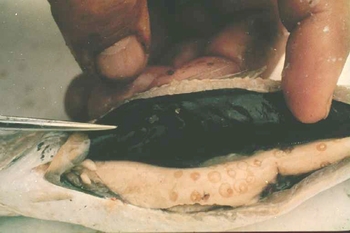
Fig. 4: Larvas de anisákidos en las vísceras de un pescado. 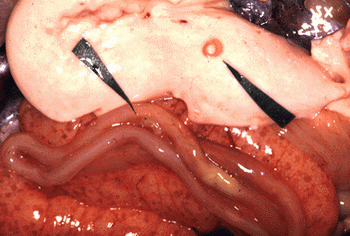
Mientras que algunos trabajos muestran la presencia más frecuente de larvas de anisákidos en las vísceras del bacalao y otros peces (Strfmnes y Andersen, 1998), otros autores demuestran la mayor frecuencia de larvas en los músculos hipoaxiales en el bacalao (Herreras et al., 2000) o en el arenque. Sin embargo, es probable que esto dependa simplemente de la disposición espacial de los órganos en las distintas especies de peces y su cercanía al intestino. Por ello la talla o peso no puede considerarse para predecir la intensidad de parasitación por larvas de anisákidos en los músculos del pescado.
También, se ha podido comprobar la migración postmortem de las larvas en arenques y caballas no eviscerados y mantenidos en hielo picado a los músculos hipoaxiales, en cambio, este fenómeno no se ha demostrado en peces "no grasos" como la bacaladilla o la merluza. Este fenómeno podría tener importantes repercusiones en países, como España, donde gran parte del pescado consumido se vende fresco y no eviscerado.
Las larvas en su localización definitiva no crecen ni se alimentan y se cree que pueden vivir durante toda la vida de los hospedadores.
Anisakiosis humana
El primer caso de anisakiosis humana se describió en Holanda en 1955 y desde entonces se han documentado casos en todo el mundo. En España el primer caso fue descrito por Arenal-Vera et al. en 1991.
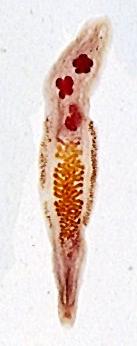
Las larvas de A. simplex y P. decipiens se localizan preferentemente en el estómago, sin embargo, hasta 30-40% de los casos de infección por A. simplex, este se localiza también en el intestino (figs. 5 y 6). Tradicionalmente la anisakiosis humana se ha dividido en anisakiosis gástrica y anisakiosis intestinal dependiendo de la zona del aparato digestivo afectada. La anisakiosis gástrica se caracteriza por dolor de estómago, nauseas y vómitos que aparecen a las pocas horas de ingerir pescado crudo parasitado. Un hallazgo laboratorial frecuente es la eosinofilia (4-41%), en cambio, la leucocitosis es inexistente o muy poco manifiesta. Si no se diagnostica correctamente los síntomas pueden permanecer desde varias semanas hasta dos años. En la anisakiosis intestinal, en cambio, los síntomas (dolor abdominal, nauseas y vómitos) aparecen aproximadamente a los siete días de la ingestión del pescado parasitado. La leucocitosis es marcada, en cambio, no existe eosinofilia. Las lesiones de la anisakiosis humana se han clasificado en cinco tipos: respuesta a un cuerpo extraño, reacción flemonosa, lesión tipo absceso, lesión absceso-granulomatosa y lesión granulomatosa.
Fig. 5: Larva de anisákido penetrando en la mucosa digestiva. 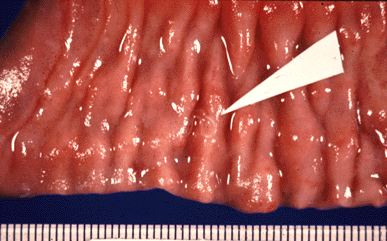
Fig 6: Anisakiosis. Imagen histológica. 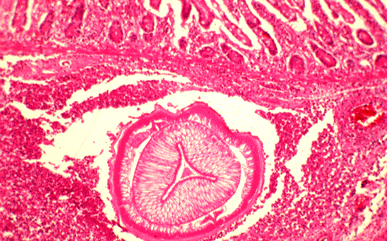
Desde mediados de la década de los noventa se han descrito la existencia de casos de anisakiosis humana por consumo de pescado parasitado, pero cuyas larvas estaban presumiblemente muertas por tratamiento térmico (Fernández de Corres et al., 1996). Se trataría de una reacción de hipersensibilidad inmediata, caracterizada por urticaria aguda, angioedema y anafilaxia, mediada por IgE específicas frente a un antígeno termoestable del parásito (del Pozo et al., 1996). Sin embargo, estudios recientes sugieren que la fuente antigénica causante de la reacción de hipersensibilidad son larvas vivas de anisákidos (López-Serrano et al., 2000b; López-Serrano et al., 2000c).
En un estudio prospectivo realizado en el Hospital Universitario "La Paz" sobre 120 pacientes con manifestaciones alérgicas, se implicó a A. simplex en 96 de los casos, extrayéndose larvas del parásito mediante endoscopía en 24 de ellos (López-Serrano et al., 2000c). Los autores denominaron a esta entidad "anisakiosis gastro-alérgica", concluyendo que la fuente antigénica que desencadenaba el proceso eran larvas del parásito vivas que debían fijarse a la submucosa del estómago para producir la reacción de hipersensibilidad. El origen de la parasitosis fue en la mayoría de los casos el consumo de boquerones en vinagre y en algunos casos, también fue por consumo de merluza fresca, aunque presumiblemente bien cocinada. Sin embargo, no se asoció ningún caso al consumo de pescado congelado industrial ni piezas de pescado bien cocidas.
Diagnóstico
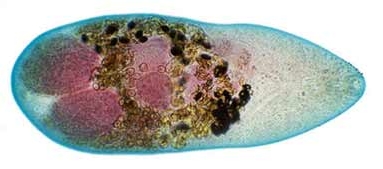
Por las manifestaciones clínicas tan inespecíficas que muestra la infección en el hombre, la detección de las larvas de anisákidos mediante endoscopía es un método adecuado (fig. 7).
Fig. 7: Anisakiosis. Imagen endoscópica. 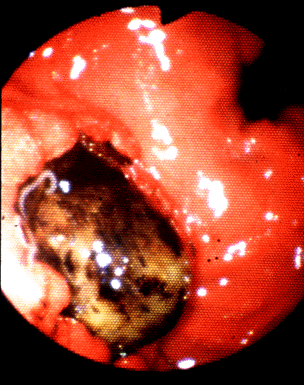
También se han normalizado diferentes pruebas serológicas (ELISA, IFI) utilizando antígenos de excreción-secreción del parásito o anticuerpos monoclonales (revisados por Lorenzo et al., 2000). Para estos autores el modo más apropiado de diagnóstico de la anisakiosis alérgica es mediante un ELISA de captura de antígenos utilizando el anticuerpo monoclonal UA3 (Lorenzo et al., 2000). Sin embargo, el antecedente dietético, la clínica, la exploración endoscópica y radiológica, la respuesta a las pruebas cutáneas y la medición seriada de IgE específicas a A. simplex son aspectos importantes también en el diagnóstico de la anisakiosis gastro-alérgica (López-Serrano et al., 2000c).
No existen fármacos eficaces frente a la anisakiosis humana y la eliminación de las larvas mediante extracción endoscópica es el tratamiento de elección.