Purificación de proteínas. Análisis de estructura primaria. Caracterización molecular y enzimática de proteínas. Análisis espectroscópicos (absorción-UV; dicroísmo circular; emisión de fluorescencia) de proteínas. Clonaje y expresión en levaduras y bacterias. Mutagénesis dirigida. Ingeniería de proteínas
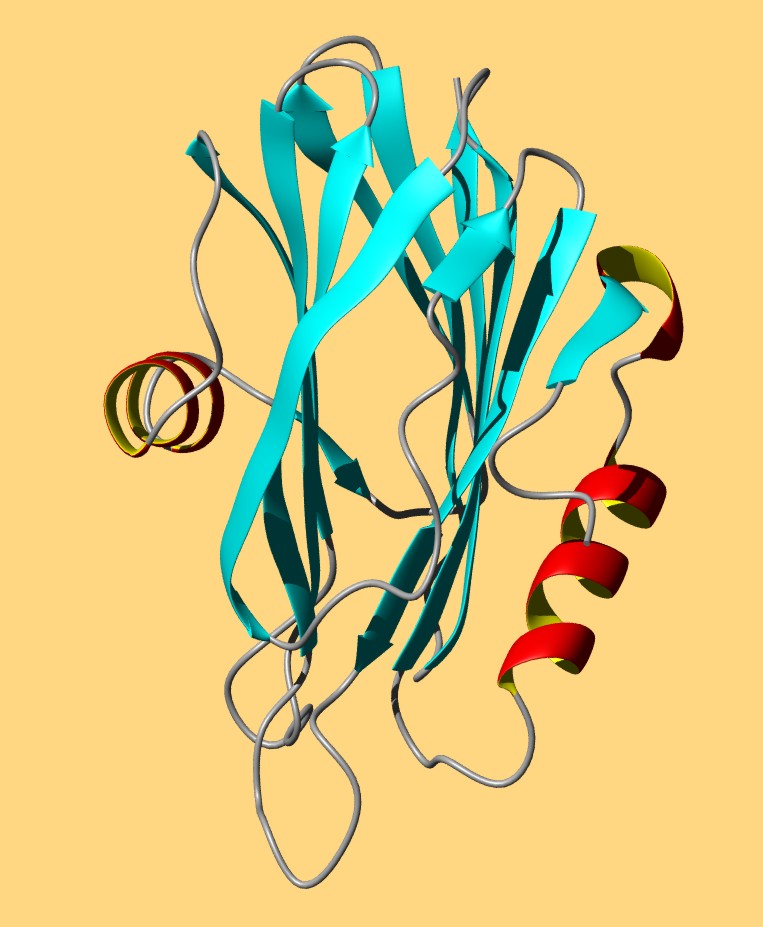
Se trata de una proteína citotóxica aislada de Aspergillus giganteus. Consta de una única cadena polipeptídica compuesta por 150 aminoácidos. Esta proteína es una ribonucleasa muy específica que inactiva los ribosomas eucarióticos e inhibe el crecimiento de varias líneas celulares procedentes de tumores humanos. Se han producido diferentes formas mutantes de esta proteína, al objeto de estudiar tanto su actividad enzimática como su capacidad para interaccionar con membranas biológicas.
Palabras clave: proteína inactivante de ribosomas; proteína de Aspergillus; proteína antitumoral; citotoxina; ribotoxina
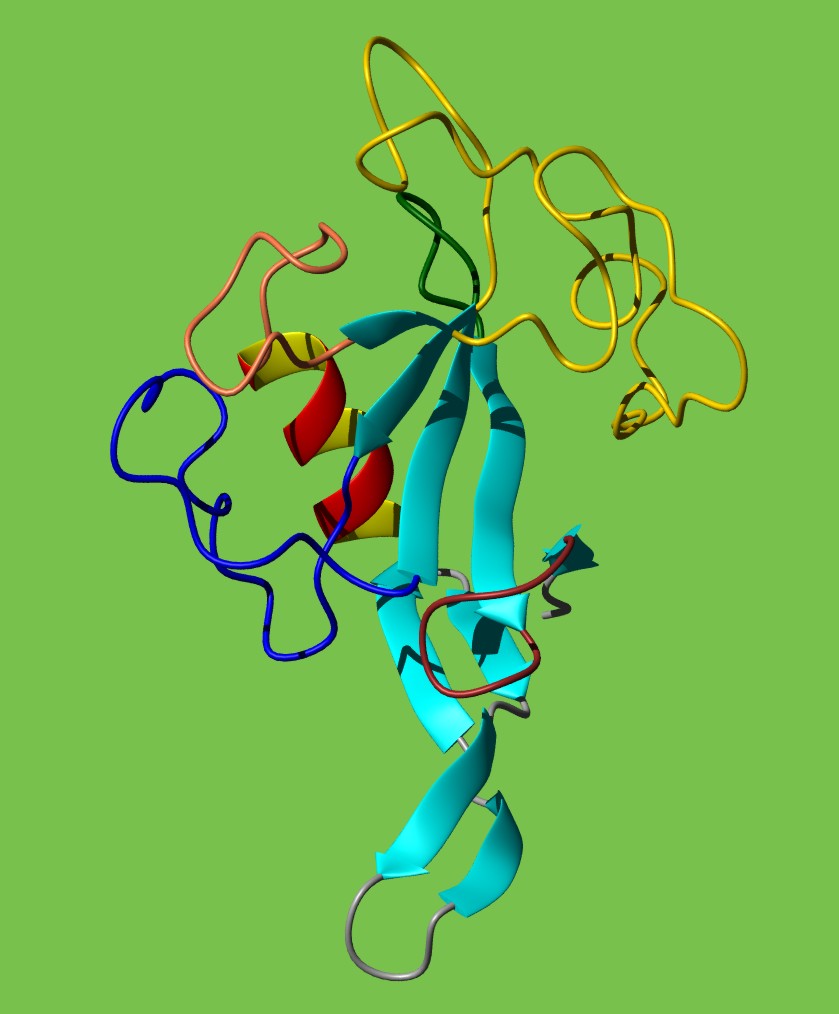
Esta proteína, secretada por el hongo Aspergillus giganteus, está compuesta por una cadena de 51 aminoácidos. Inhibe el crecimiento de diferentes hongos filamentosos. Interacciona fuertemente con vesículas de fosfolípidos ácidos, y muestra una destacable resistencia a la proteolisis y una elevada estabilidad térmica.
Palabras clave: proteína antifúngica; proteína rica en cisteina; proteína de Aspergillus

Esta proteína, aislada de la anémona marina Stichodactyla helianthus, muestra una potente actividad citolítica. Está formada por una única cadena polipeptídica de 175 aminoácidos, e interacciona fuertemente con membranas lipídicas, permitiendo la liberación de solutos intravesiculares.
Palabras clave: citolisina; proteína de S.helianthus; permeabilización de membranas