En este capítulo únicamente se consideran los aspectos de la calidad relativos a la inocuidad y alteración del pescado. Se enumeran los diversos agentes epidemiológicos relacionados con el consumo de pescados y se presentan algunas características importantes para la evaluación de los riesgos y posibilidades de riesgo relacion adas con su presencia en el pescado y sus productos. Se mencionan brevemente los procesos que provocan el deterioro, así como las opciones para la lucha contra los agentes epidemiológicos y los procesos de deterioro.
Las bacterias patógenas transmitidas por el pescado se pueden dividir convenientemente en dos grupos como se muestra en el Cuadro 3.1.
| Modalidad de acción | Estabilidad de las toxinas al calor | Dosis infecciosa mínima | |||
|---|---|---|---|---|---|
| Infección | Toxina preformada | ||||
| Bacterias autóctonas (Grupo 1) | Clostridium botulinum | + | baja | - | |
| Vibrio sp. | + | alta | |||
| V. Cholerae | - | ||||
| V. Parahaemolyticus | (> 106/g) | ||||
| otros vibrios1) | - | ||||
| Aeromonas hydrophila | + | Desconocida | |||
| Plesiomonas shigelloides | + | Desconocida | |||
| Listeria monocytogenes | + | Desconocida/ variable | |||
| Bacterias no autóctonas (Grupo 2) | Salmonella sp. | + | desde<102 a>106 | ||
| Shigella | + | 101 – 102 | |||
| E. coli | + | 101 – 1032) | |||
| Staphylococcus aureus | + | alta | - | ||
1) Otros vibrios son: V. vulnificus, V.
hollisae, V. furnsii, V. mimicus, V. fluvialis.
2) Para la cepa 0157:H7 productora de verotoxina.
Las bacterias que pertenecen al grupo 1 son comunes y están ampliamente distribuidas en los medios acuáticos de diferentes lugares del mundo. La temperatura del agua tiene claramente un efecto selectivo. Así, los organismos psicrotróficos (C. botulinum y Listeria) abundan en el Artico y en los climas más fríos, mientras que los tipos mesofílicos (V. cholerae, V. parahaemolyticus) representan parte de la flora natural de los peces de los hábitats costeros y estuarinos de las zonas templadas o tropicales cálidas.
No obstante, se debe poner de relieve que todos los géneros de bacterias patógenas mencionados anteriormente contienen cepas ambientales no patógenas. En algunos organismos es posible establecer una correlación entre ciertas características y la patogenicidad (p. ej. el ensayo Kanagawa para el V. parahaemolyticus), mientras en otros no se dispone de métodos (p. ej. Aeromonas sp.).
Si bien es verdad que todos los pescados y sus productos que no han sido sometidos a un proceso bactericida, pueden estar contaminados por uno o más de estos patógenos, normalmente el nivel de contaminación es bastante bajo y es imporbable que las cantidades naturalmente presentes en el pescado sin cocinar sean suficientes para provocar enfermedades. Una excepción son los casos en los que los patógenos se concentran debido a la filtración en los moluscos. Por otra parte, se pueden encontrar niveles altos de bacterias del grupo 1 como resultado de su desarrollo en productos pesqueros. Esta situación constituye un grave riesgo con una alta posibilidad de causar enfermedades. Por tanto, se debe evitar la multiplicación (y la posible producción de toxinas). En el Cuadro 3.2 se enumeran algunos de los requisitos para el desarrollo de los microorganismos del grupo 1. A continuación se examinan algunas características esenciales concernientes a algunos de los microorganismos mencionados.
Como se muestra en la Figura 3.1 el C. botulinum está distribuido extensamente en suelos, sedimentos acuáticos y peces (Huss 1980, Huss y Pedersen 1979).
El botulismo humano es una enfermedad grave pero relativamente rara. La enfermedad consiste en una intoxicación causada por una toxina preformada en los alimentos. Los síntomas pueden incluir náuseas y vómitos seguidos por diversas señales neurológicas y síntomas: trastornos de la visión (visión borrosa o doble), pérdida de las funciones normales de la boca y de la garganta, debilidad o parálisis total, y fallo respiratorio que es normalmente la causa de la muerte.
El examen de 165 brotes de botulismo causados por productos pesqueros puso en evidencia que los alimentos sometidos a tratamientos de preservación ligeros (ahumados, fermentados) representan, dentro de todo, el grupo más peligroso, como se muestra en el Cuadro 3.3.
| Bacterias patógenas | Temperatura (°C) | pH | aw | NaCl(%) | Resistencia al calor | |
|---|---|---|---|---|---|---|
| mínima | óptima | mínimo | mínima | máximo | ||
| C. botulinum | ||||||
| tipo proteolítico A, B, F | 10 | aprox. 35 | 4,0–4,6 | 0,94 | 10 | D121 de esporas = 0,1–0,25 min. |
| tipo no proteolítico B, E, F | 3,3 | aprox.30 | 5,0 | 0,97 | 3–5 | D82.2 = 0,15–2,0 min. en caldo |
| D80 = 4,5–10,5 min. en productos con alto contenido de proteína y grasa6) | ||||||
| Vibrio sp. | 5–8 | 37 | 5,0 | D71 = 0,3 min.1) | ||
| V. cholerae | 5 | 37 | 6,0 | 0,97 | <8 | D55 = 0,24 min.2) |
| V. parahaemolyticus | 5 | 37 | 4,8 | 0,93 | 8–10 | 60°C durante 5 min. mostraron un descenso 7 log10en V. parahaemolyticus |
| V. vulnificus | 8 | 37 | 5,0 | 0,94 | 5 | |
| Aeromonas sp. | 0–4 | 20–35 | 4,0 | 4–5 | D55 = 0,17 min.5) | |
| Plesiomonas sp. | 8 | 37 | 4,0 | 4–5 | 60°C/30 min. no hay supervivencia7) | |
| Listeria monocytogenes | 1 | 30–37 | 5,0 | 0,924) | 10 | D60 = 2,4–16,7 min. en productos cárnicos3) |
| D60 = 1,95–4,48 min. en pescado (Figura 3.3) | ||||||
1) Shultz et al.(1984)
2) Delmore y Crisley 1979)
3) Farber y Peterkin (1991)
4)
Nolan et al. (1992)
5) Condon et
al.(1992)
6) Conner et
al.(1989)
7) Miller y Koburger (1986)2)
Delmore y Crisley 1979)
| Productos de pescado | Procedimiento utilizado | No de brotes |
|---|---|---|
| Ligeramente conservado | ahumado | 10 |
| fermentado | 113 | |
| Semiconservado | salado | 9 |
| marinado | 8 | |
| Completamente conservado | enlatado | 5 |
| Desconocido | 20 | |
| Total | 165 |
En contraste se observa que nunca se ha demostrado que el pescado fresco o congelado cause botulismo humano. Esto probablemente se debe al hecho de que el pescado fresco normalmente se deteriora antes de volverse tóxico. La última protección viene dada por la estabilidad muy baja al calor de la toxina botulínica (Huss 1981, Hauschild 1989), lo que significa que la preparación casera de la comida por cocción completa destruirá cualquier toxina preformada. Asi, el riesgo está claramente relacionado con los alimentos que no precisan ser cocinados (alimentos crudos) inmediatamente antes de su consumo.
El botulismo puede prevenirse inactivando las esporas bacterianas en productos envasados y esterilizados al calor, o inhibiendo el desarrollo en el resto de los productos. C. botulinum se clasifica según el tipo de toxina desde A a la G, y los tipos patógenos para el hombre se pueden dividir por conveniencia en dos grupos:
Los tipos proteolíticos A y B, que también son resistentes al calor, mesofilicos y tolerantes al NaCl.
Los tipos no proteolíticos E, B y F, que son sensibles al calor, psicrotróficos y sensibles al NaCl. Sobre todo son los tipos no proteolíticos los que se encuentran en el pescado y en sus productos.
En general, los procedimientos de envasado han sido concebidos para destruir un gran número de los tipos de C. botulinum resistentes al calor. Así, se ha definido la “cocción botulínica” como equivalente a 3 min. a 121°C. Este valor se conoce también como valor F0o “valor del proceso”.
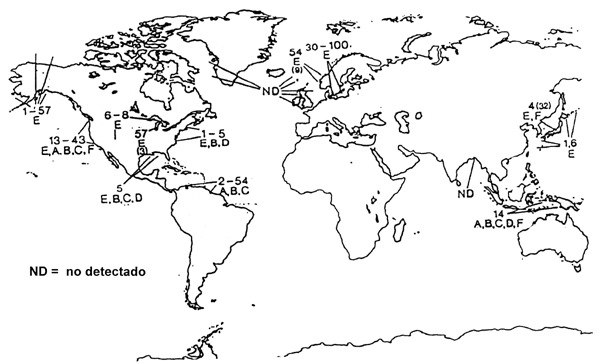
Figura 3.1Incidencia (por ciento) de C. botulinum en pescado. Las letras A-F indican la presencia de los tipos A-F C. bobulinum. Ver Huss (1980) para referencias de los distintos estudios
El valor F0 necesario para envasar un producto de pescado es equivalente a 12 reducciones decimales en el número de esporas de Clostridium botulinum. Utilizando los valores D más altos que se conocen (0.25 min. a 121°C) el F0 es, por tanto, igual a 12 × 0,25 = 3. Este es el así llamado concepto 12 D previsto para reducir la carga bacteriana de mil millones de esporas en cada una de 1000 latas a una espora en 1000 latas.
En cambio, el valor D para los grupos no proteolíticos es mucho más bajo. Tomando como base los datos presentados por Angelotti (1970), un proceso de calor húmedo de 82,2 °C durante 30 min. deberá destruir aproximadamente 107 esporas. Por lo tanto, la pasteurización comercial por calor (en productos envasados al vacío, en ahumados en caliente) puede no ser suficiente para destruir todas las esporas y la inocuidad de estos productos debe basarse en un control completo del desarrollo y producción de toxinas.
En el Cuadro 3.2 se enumeran algunas de las limitaciones más importantes para el desarrollo de C. botulinum. Aunque se muestra que las cepas no proteolíticas pueden desarrollarse hasta en un 5 por ciento de NaCl, esto sólo ocurre en condiciones óptimas. En los productos pesqueros almacenados a baja temperatura (10°C) un 3 por ciento de NaCl en la fase acuosa es suficiente para inhibir el desarrollo del tipo E durante al menos 30 días (Cann y Taylor 1979).
En el Cuadro 3.4 se resumen los aspectos más importantes de la inocuidad de los diversos tipos de productos de pescado.
La mayoría de los vibrios son de origen marino y requieren Na+ para su desarrollo. El género contiene varias especies que son patógenas para el hombre según se enumera en el Cuadro 3.1. V. cholerae está presente en forma de dos serotipos, el 01 y el no-01, y el serotipo 01 existe en dos biovares: el “clásico” y el “El tor”. El biovar clásico, el serovar 01, hoy en día está restringido a partes de Asia (Bangladesh), la mayoría de los cóleras son causados por el biovar El tor. Las especies patógenas son principalmente mesófilas, es decir, generalmente se encuentran (omnipresentes) en aguas tropicales y en cantidades máximas en aguas templadas a finales de verano o principios de otoño.
Las enfermedades relacionadas con Vibrio sp. se caracterizan por síntomas gastroenteríticos que varían desde una diarrea leve hasta el cólera clásico, con profusa diarrea acuosa. Una excepción la constituyen las infecciones con V. vulnificus, que principalmente se caracterizan por septicemia.
Los mecanismos de patogenicidad de los vibrios no están completamente claros. La mayoría de los vibrios producen potentes enterotoxinas, tan sólo 5 μg de la toxina del cólera (TC) administrados oralmente produjeron diarrea en voluntarios (Varnam y Evans, 1991). Otras toxinas diferentes son producidas por V. cholerae, entre las que se incluyen una hemolisina, una toxina similar a la tetrodotoxina y otra semejante a la shiga-toxina. Se sabe que las cepas patógenas de V. parahaemolyticus producen una hemolisina directa termoestable (Vp-HDT), que provoca la reacción de Kanagawa, pero hoy en dia está comprobado que también V. parahaemolyticus Kanagawa negativos son capaces de causar la enfermedad (Varnam y Evans 1991).
| Productos de pescado | Factores que aumentan el riesgo de botulismo | Factores que reducen el riesgo de botulismo | Inocuidad del producto basada en: | Clasificación |
|---|---|---|---|---|
| Fresco y congelado | Envasado al vacío | Almacenamiento refrigerado tradicional Putrefacción antes de producirse la toxina | Cocinar antes de comer | Sin riesgo |
| Pasteurizado | Prolongada duración en almacén Toxina producida antes de la putrefacción Envasado al vacío Higiene deficiente | Almacenamiento final en frío(<3°C) Eliminación de la flora aeróbica sinérgica | Cocinar antes de comer Almacenamiento refrigerado | Sin riesgo si se cocina Alto riesgo si no se cocina |
| Ahumado en frío | Igual que el producto anterior No cocinar antes de comer No se acostumbra su almacenamiento en frío | Almacenamiento final en frío Salazón (concentración NaCl>3%) Potencial redox alto en productos no deteriorados | Almacenamiento refrigerado Control del proceso (Materia prima, salazón cuando sea aplicable) | Alto riesgo |
| Fermentado | Fermentación lenta Temperatura alta durante la fermentación No cocinar antes de comer | Salzón (concentración NaCl>3% en la salmuera) Almacenamiento final refrigerado Bajo pH | Control del proceso Almacenamiento refrigerado | Alto riesgo |
| Semiconservado | No cocinar antes de comer | Aplicación de sal, ácido, etc. Almacenamiento final refrigerado | Control del proceso | Bajo riesgo |
| Completamente conservado | No cocinar antes de comer Envasado en latas cerradas | Tratamiento en autoclave Cierres herméticos correctos | Control del proceso (Tratamiento en autoclave, cerrado de envases) | Bajo riesgo |
Los citados Vibrio sp. no siempre son patógenos. A la mayoría de las cepas naturales les faltan los factores de colonización necesarios para la adherencia y penetración, toxinas apropiadas u otros determinantes de la virulencia, necesarios para causar la enfermedad.
En los últimos años se ha demostrado que los vibrios son capaces de responder a condiciones ambientales adversas, pasando a una fase viable pero no cultivable (Colwell 1986). Cuando las bacterias se exponen a condiciones adversas de salinidad, temperatura o privación de nutrientes, pueden ser dañadas reversiblemente y no es posible detectarlas por métodos bacteriológicos normales. No obstante, cuando se les proporcionan condiciones óptimas pueden retornar al estado normal “cultivable”.
Una consecuencia obvia de este fenómeno es que los exámenes de rutina de estos patógenos en muestras ambientales pueden ser negativos, aunque en realidad las bacterias patógenas están de hecho presentes.
Históricamente el cólera ha sido una enfermedad de los pobres y malnutridos, pero esto en cierto grado se debe a niveles de higiene bajos. En el caso del cólera, el agua y la contaminación fecal del agua son las causas principales de la difusión de la enfermedad; sin embargo, los alimentos son cada vez más importantes.
Una amplia cantidad de alimentos actúan como vehiculos para la transmisión del cólera, en particular los refrescos, frutas y hortalizas, leche, cerveza de fermentación casera, así como las gachas de mijo (Varnam y Evans 1991). No obstante, se ha demostrado que el pescado crudo, sin cocinar o cocinado insuficientemente, o cocinado pero que ha sufrido contaminación cruzada, es el mayor vehículo para el V. cholerae 01 y el no-01 (Morris y Black 1985). Muy a menudo los brotes de V. parahaemolyticus se han asociado con contaminación cruzada o abuso en el factor tiempo/temperatura del pescado cocinado. Una excepción es el Japón donde el pescado crudo es el vehículo más común de infección con V. parahaemolyticus. Para el resto de los vibrios el consumo de mariscos crudos, en especial ostras, es la mayor causa de infección.
Un aspecto importante es la considerable tasa de multiplicación observada en los vibrios presentes en el pescado natural, incluso a temperaturas reducidas. Esto permite que cantidades iniciales relativamente bajas aumenten espectacularmente en condiciones inadecuadas de captura (cosecha), preparación, distribución y almacenamiento.
La falta de higiene y la carencia de agua potable son las principales causas de las epidemias de cólera. Por lo tanto, el cólera sólo puede prevenirse en forma confiable asegurando que todas las poblaciones tengan acceso a sistemas adecuados de eliminación de excrementos y al agua potable. Como consecuencia del reciente brote de cólera en América Central y América del Sur, la Organización Mundial de la Salud (WHO 1992) ha publicado las siguientes recomendaciones sobre el suministro de agua y la higiene para la prevención y lucha contra el cólera:
Suministro de agua - recomendaciones de la OMS:
Debe desinfectarse adecuadamente el agua potable. Deben mejorarse los procedimientos para la desinfección en los sistemas de distribución y en los sistemas de agua rurales.
Pueden distribuirse entre la población tabletas que liberan cloro o iodo, con instrucciones para su uso.
En caso de que no sea posible el tratamiento químico del agua, los instructores sanitarios deben hacer hincapié en que el agua para beber (así como para lavarse las manos y lavar los utensilios) debe hervirse antes de su uso.
El control de la calidad del agua debe reforzarse intensificando la vigilancia, el control del cloro residual y la ejecución de análisis bacteriológicos, en diferentes puntos de los sistemas de producción y distribución.
Higiene - recomendaciones de la OMS:
Debe reforzarse el control de calidad en las plantas de tratamiento de aguas residuales.
Debe controlarse cuidadosamente la utilización de aguas residuales tratadas para el riego, siguiendo las directrices nacionales e internacionales.
El tratamiento químico a gran escala de las aguas residuales rara vez está justificado, inclusive en emergencias, debido al alto coste, efecto incierto y posible impacto adverso sobre el medio ambiente y la salud.
En la educación sanitaria debe hacerse hincapié en la eliminación segura de las heces humanas:
Todos los miembros de la familia deben disponer de una letrina o cuarto de baño que se desinfecte y limpie con regularidad, y
Las heces de los bebés y de los niños deben eliminarse con rapidez en la letrina o cuarto de baño, o enterrándolas.
Los vibrios se destruyen fácilmente con el calor. Así, para eliminar la mayoría de los vibrios es suficiente cocinar adecuadamente. No obstante, Blake et al. (1980) determinaron que el V. cholerae 01 sobrevivía hasta después de 8 min. de hervor y de 25 min. de cocción al vapor en cangrejos contaminados de forma natural. Por tanto, la práctica comercial de dar un golpe de calor a las ostras en agua hirviendo para facilitar su apertura, no es suficiente para asegurar su inocuidad cuando se consumen crudas.
A temperaturas adecuadas el desarrollo de los vibrios puede ser muy rápido. En condiciones óptimas (37°C) se han observado tiempos de multiplicación de tan sólo 8–9 min.
A temperaturas más bajas las tasas de multiplicación se reducen, pero según Bradshaw et al. (1984) concentraciones iniciales de V. parahaemolyticus de 102 ufc/g en camarón homogeneizado aumentaron hasta 108 ufc/g después de 24 horas a 25°C. Estos resultados demuestran que una refrigeración adecuada es fundamental para controlar esta proliferación desproporcionada.
El almacenamiento a baja temperatura ha sido propuesto como un medio para eliminar los vibrios patógenos de los alimentos. No obstante, este método no es lo suficientemente confiable para su aplicación comercial. En el Cuadro 3.5 se muestran los tiempos de supervivencia de V. cholerae según Mitscherlich y Marth (1984).
| Alimento | Tiempos de supervivencia (días) |
|---|---|
| Pescado almacenado a 3–8°C | 14–25 |
| Hielo almacenado a –20°C | 8 |
| Camarón congelado | 180 |
| Hortalizas en cámara húmeda, 20°C | 10 |
| Zanahorias | 10 |
| Coliflor | 20 |
| Agua de río | 210 |
El género Aeromonas ha sido clasificado dentro de la familia Vibrionaceae y contiene especies patógenas para los animales (peces) y el hombre. En años recientes las Aeromonas sp. móviles, en particular A. hydrophila, han recibido una atención cada vez mayor, por su papel como posible agente de enfermedades diarreicas transmitidas por alimentos. No obstante, el papel de Aeromonas como patógeno entérico no está completamente aclarado.
Las Aeromonas son usuales en medios de agua dulce, pero también se pueden aislar a partir de aguas saladas y estuarinas (Knøchel 1989). También se puede aislar fácilmente este organismo en la carne, el pescado, helados y muchos otros alimentos según la revisión de Knøchel (1989). Ciertamente, se ha identificado este organismo como el principal causante del deterioro de la carne cruda (Dainty et al. 1983), del salmón crudo (Gibson 1992) envasado en vacío o en atmósferas modificadas, y del pescado de aguas tropicales (Gram et al. 1990, Gorczyca y Pek Poh Len 1985).
Las especies de Aeromonas segregan una amplia gama de toxinas como la enterotoxina citotóxica, las hemolisinas y una tetrodotoxina semejante a la inhibidora de la “bomba de sodio” (Varnam y Evans 1991). No obstante, el papel de estas toxinas como causantes de las enfermedades del hombre no está resuelto, y en la actualidad no existe un método para diferenciar entre las cepas ambientales no patógenas y las cepas patógenas. Así, no hay pruebas de que las toxinas preformadas en los alimentos jueguen algún papel, y la asociación entre comer pescado y la infección con Aeromonas es, en el mejor de los casos, circunstancial (Ahmed 1991).
En el Cuadro 3.2 se muestran algunos factores que limitan el desarrollo de Aeromonas. Mientras la temperatura mínima de desarrollo para las cepas clínicas es de unos +4 °C (Palumbo et al. 1985), se ha demostrado que las cepas ambientales y aisladas de los alimentos se desarrollan a 0 °C (Walker y Stringer 1987). Las Aeromonas son muy sensibles a las condiciones ácidas y a la sal, por lo que probablemente no se planteará el problema de su desarrollo en alimentos con un pH menor de 6,5 y un contenido de NaCl mayor del 3,0 por ciento.
El género Plesiomonas se encuentra situado también dentro de la familia Vibrionaceae. Al igual que otros miembros de esta familia, las Plesiomonas se encuentran ampliamente distribuidas en la naturaleza, pero fundamentalmente relacionadas con el agua, tanto dulce como salada (Arai et al. 1980). Debido a su naturaleza mesofilica (véase el Cuadro 3.2) hay una acentuada variación estacional en las cantidades aisladas a partir de agua, siendo mucho mayores durante los períodos más cálidos. Es común su transmisión por los animales y por el intestino de los peces, y es probable que el pescado sea el reservorio primario de Plesiomonas shigelloides (Koburger 1989).
Las Plesiomonas sp. pueden causar gastroenteritis con síntomas que van desde una enfermedad moderada de corta duración hasta una diarrea grave (como la de shigela o como la del cólera). No obstante, es posible que sólo algunas cepas posean características virulentas, ya que voluntarios que han ingerido el microorganismo no siempre han enfermado (Herrington et al. 1987). Al igual que en las Aeromonas, en la actualidad no hay forma de diferenciar las Plesiomonas sp. patógenas de las no patógenas.
En el Cuadro 3.2 se presentan los factores que limitan el desarrollo.
En la actualidad se han identificado seis especies de Listeria, pero sólo tres especies, L. monocytogenes, L. ivanovii y L. seeligeri, están relacionadas con enfermedades del hombre y/o los animales. No obstante, los casos humanos en los que intervienen L. ivanovii y L. seeligeri son extremadamente raros, con únicamente cuatro casos detectados. La L. monocytogenes está subdividida en 13 serovares según el antígeno somático (O) y el flagelar (H). Esta subdivisión es de valor limitado en estudios epidemiológicos dado que la mayoría de los aislados pertenecen a tres serotipos. El marcado por fagos, el marcado por isoenzimas y la impresión digital de ADN (“fingerprints”) son los métodos más interesantes. Con este último se han obtenido resultados prometedores (Facinelli et al. 1988, Bille et al. 1992, Gerner-Smidt y Nørrung 1992).
L. monocytogenes abunda en la naturaleza. Según revisiones de Lovett (1989), Ryser y Marth (1991) y Fuchs y Reilly (1992), se puede aislar a partir del suelo, la vegetación, los alimentos incluidos el pescado y sus productos, y las cocinas domésticas. La mayoría de las cepas ambientales probablemente no son patógenas.
Otras Listeria sp. distintas de L. monocytogenes parecen ser más comunes en áreas tropicales (Fuchs y Reilly 1992, Karunasagar et al. 1992).
La listeriosis es una infección que tiene como punto de entrada el intestino, sin embargo, no se conoce la dosis infecciosa. El período de incubación puede variar de un dia a varias semanas. Las cepas virulentas son capaces de multiplicarse en los macrófagos y producir septicemia, seguida por la infección de otros órganos como el sistema nervioso central, el corazón, y los ojos, y pueden invadir los fetos de las mujeres embarazadas. En adultos sanos, normalmente la listeriosis nunca se desarrolla más allá de la fase entérica primaria, que puede no presentar síntomas o tener sólo síntomas leves “de tipo resfriado”. La listeriosis es particularmente peligrosa y puede ser letal para los fetos, las mujeres embarazadas, los neonatos y las personas inmunodeprimidas.
Todos los productos lácteos (leche, queso, helado, crema) han sido relacionados con brotes de listeriosis, al igual que las ensaladas vegetables y las hortalizas. Cada vez se acepta más que los alimentos contaminados son un vehículo importante de L. monocytogenes. Los aislamientos frecuentes a partir del pescado (Weagant et al. 1989, Rørvik y Yndestad 1991) y la demostración del potencial de proliferación en salmón ahumado en frío (+4 °C) (Ben Embarek y Huss 1992, Guyer y Jemmi 1991, Rørvik et al. 1991, Fuchs y Reilly 1992), son pruebas de que el pescado puede ser importante en la transmisión de Listeria monocytogenes. No obstante, hasta el momento ha habido sólo dos casos documentados debidos a pescado (Facinelli et al. 1989, Frederiksen 1991) y dos casos en los que se ha sospechado haberse debido a los mismos (Lennon et al. 1984, Riedo et al. 1990).
En la actualidad la FDA (Food and Drug Administration) de los Estados Unidos de Norte América exige la ausencia de L. monocytogenes en productos pesqueros listos para el consumo, tales como la carne de cangrejo o el pescado ahumado. Esta restricción no se aplica a productos crudos que se cocinan antes de comer (Ahmed 1991). Otros países tienen reglamentos análogos, que son muy poco realistas, dado que, p. ej., el pescado ahumado en frío no ha sido sometido a un proceso listericida. Debido a la naturaleza ubicua de L. monocytogenes estos productos no se pueden garantizar como exentos de L. monocytogenes. En la actualidad la FDA está considerando posibles cambios en su reglamento (Archer 1992). Los productos se clasificarán de acuerdo con las posibilidades de riesgo conocidas y establecidas. De momento se mantendrá una tolerancia cero para productos que han recibido un tratamiento listericida, así como para productos que han estado directamente relacionados con brotes transmitidos por alimentos. Por tanto, pueden permitirse cantidades bajas de L. monocytogenes en otros tipos de productos, en particular, en aquellos en que pueda demostrarse que el microorganismo muere.
Existe un consenso general entre los microbiólogos de que puede ser necesario tolerar la presencia en nuestros alimentos de bajas cantidades de L. monocytogenes. No obstante, Notermans et al. (1992) sugieren que es razonable un límite de 100 L. monocytogenes/g, mientras que Skovgaard (1992) piensa que probablemente más de 10 L. monocytogenes/g pueden suponer un riesgo para el hombre, en particular, en personas predispuestas (muy ancianas, muy jóvenes o inmunodeprimidas). Las cifras mencionadas deben compararse con el nivel de fondo de L. monocytogenes en los alimentos, que es aprox. 1–10 L. monocytogenes/g (Skovgaard 1992). Esto significa que no se debe tolerar ni poco ni ningún desarrollo en los alimentos.
No obstante, el nivel cuantitativo de contaminación de L. monocytogenes en productos pesqueros puede mantenerse muy bajo (<1–10/g) mediante unas buenas prácticas de manufactura e higiene adecuadas en la planta. Según Ryser y Marth (1991) L. monocytogenes es sensible a los agentes desinfectantes. Así, los tipos de desinfectantes a base de cloro, yodo, ácidos aniónicos y amonio cuaternario son eficaces contra L. monocytogenes a concentraciones de 100 ppm, 25–45 ppm, 200 ppm y 100–200 ppm, respectivamente.
En el Cuadro 3.2 se enumeran algunos factores limitantes del desarrollo.
El control posterior de las enfermedades en productos que no han sufrido un tratamiento listericida se basa en el control del desarrollo en los productos. Debe observarse que L. monocytogenes es dificil de controlar en productos pesqueros almacenados refrigerados, como p. ej., pescado ahumado en frío. El organismo puede desarrollarse a temperaturas inferiores a +1°C y es tolerante al NaCl (hasta el 10 por ciento a pH neutro y 25 °C). El nitrito no es un inhibidor de L. monocytogenes a los niveles permitidos, a menos que exista una interacción con otros agentes inhibidores (Shahamat et al. 1980). Así, Ben Embarek y Huss (1993) demostraron que no existe desarrollo de L. monocytogenes en salmón ahumado en frío envasado al vacío con un contenido de 5,4 por ciento NaCl en la fase acuosa y almacenado a 5°C durante 25 días. No obstante, se demostró que había proliferación en salmón ahumado en frío (2,5–3,2 por ciento de NaCl en la fase acuosa) y almacenado a 4°C, tanto en los casos no envasados al vacío (Guyer y Jemmi 1991) como en los envasados al vacio (Rørvik et al. 1991). Las diferencias en el contenido de NaCl y en las cepas utilizadas pueden explicar por qué se observaron diferentes resultados en estos experimentos.
El tratamiento listericida consiste principalmente en un tratamiento de calor. Según Mackey y Bratchell (1989), la resistencia al calor de L. monocytogenes ha sido objeto de investigaciones generalizadas, en particular, en leche y productos lácteos. La curva tiempo-temperatura letal (CTTL) para L. monocytogenes en bacalao y salmón fue estudiada por Ben Embarek y Huss (1993). Los resultados muestran una resistencia al calor considerablemente más alta de L. monocytogenes en filetes de salmón en comparación con filetes de bacalao, con D60 igual a 4,5 min. en salmón y 1,8 min. en bacalao. Los valores z fueron en ambos casos aproximadamente 6°C como se muestra en la Figura 3.2, valores muy similares al valor z calculado por Mackey y Bratchell (1989).
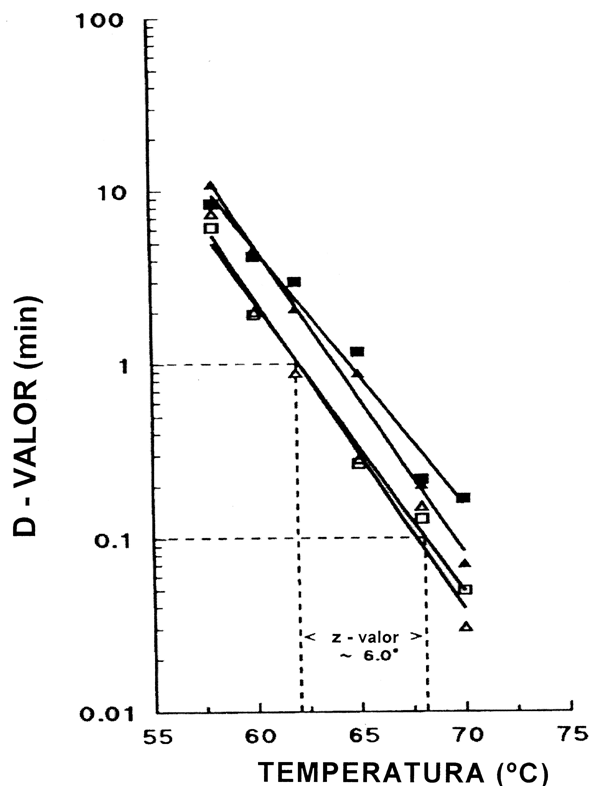
Figura 3.2 Resistencia al calor de L. monocytogenes en filetes de bacalao (simbolos huecos) y filetes de salmón (símbolos llenos). Los prganismom de ensayo se aislaron a partir de salmón ahumado (cuadrados) y un caso clínico de listeriosis (triángulos) (Ben Embarek y Huss 1993).
En el Cuadro 3.6 se enumeran algunos de los requerimientos para el desarrollo de los organismos del grupo 2.
Las Salmonella son miembros de la familia Enterobacteriaceae y están presentes en más de 2000 serovares. Estos organismos mesófilos se distribuyen geográficamente por todo el mundo, pero principalmente se encuentran en el intestino del hombre y de los animales, y en medios contaminados con excremento humano o de animales. La supervivencia en agua depende de muchos parámetros, particularmente de los factores biológicos (interacción con otras bacterias) y los factores físicos (temperatura). Rhodes y Kator (1988) han demostrado que tanto E. coli como Salmonella sp. pueden multiplicarse y sobrevivir en medios estuarinos durante semanas, mientras que Jiménez et al. (1989) presentaron resultados similares de supervivencia en medios tropicales de agua dulce.
Los principales síntomas de la salmonelosis (infecciones no tifoideas) son diarreas no sanguinolentas, dolor abdominal, fiebre, náuseas, vómitos que generalmente aparecen 12–36 horas después de la ingestión. No obstante, los síntomas pueden variar considerablemente desde una enfermedad grave de tipo tifoideo a una infección asintomática. La enfermedad también puede dar lugar a complicaciones más serias. La dosis infectiva en personas sanas varía dependiendo de los serovares, el tipo de alimento y la susceptibilidad del individuo. Existen pruebas de una dosis mínima infectiva (D.M.I.) de tan sólo 20 células (Varnam y Evans 1991) mientras que otros estudios han demostrado consistentemente que son necesarias >106 células.
La Salmonella normalmente está presente en las aves y los animales domésticos y muchos son excretadores asintomáticos de Salmonella. Por tanto, la carne cruda de dichos animales y aves a menudo está contaminada por este organismo. Según una revisión de D'Aoust (1989) se han realizado numerosos estudios que demuestran que la incidencia varía según la especie, las prácticas agropecuarias y la elaboración. En la mayoría de los países industrializados, con una cría intensiva de aves, son positivas entre el 50–100 por ciento de todas las muestras de carcazas de pollo, pero también en otras carnes la contaminación puede alcanzar casi el 100 por ciento. La contaminación de la leche cruda y de los huevos, y sus productos, con Salmonella también es un problema bien conocido.
La contaminación del pescado con Salmonella debido a su proliferación en aguas costeras contaminadas ha sido un problema en muchas partes del mundo. En un estudio reciente de Reilly et al. (1992) se han presentado pruebas de que los camarones cultivados en el trópico frecuentemente contienen Salmonella. No obstante, se ha demostrado que la Salmonella en los productos del camarón de acuicultura se origina a partir del medio ambiente, más que como resultado de condiciones deficientes de higiene y saneamiento, y de la utilización del estiércol de ave como pienso.
| Bacterias patógenas | Temperatura (°C) | pH | NaCl (%) | aw | Resistencia al calor | ||
|---|---|---|---|---|---|---|---|
| mínima | óptima | máxima | mínimo | máximo | mínima | ||
| Salmonella | 5 | 37 | 45–47 | 4,0 | 4–5 | 0,94 | D60=0,2–6,5 min. |
| Shigella | 7–10 | 37 | 44–46 | 5,5 | 4–5 | 60°C/5 min. | |
| E. coli | 5–7 | 37 | 44–48 | 4,4 | 6 | 0,95 | D60=0,1 min. D55=5 min. |
| Staphylococcus aureus | 7 | 37 | 48 | 4,0 | 10–15 | 0,83 | D60=0,43–7,9 min. |
| Staphylococcus aureus producción de toxinas | 15 | 40–45 | 46 | aprox. 5,0 | 10 | 0,86 | Alta estabilidad al calor de la toxina |
En la mayor parte de la bibliografía se indica que el pescado es un vehículo mucho menos común, por lo que respecta a la Salmonella, que otros alimentos, y que el pescado es vehículo de tan sólo una pequeña proporción del número total de casos de Salmonella descritos en los Estados Unidos y en otras partes (Ahmed 1991). La mayoría de los langostinos y los camarones se cocinan antes de su consumo y, por lo tanto, estos productos representan riesgos mínimos para la salud del consumidor, excepto por contaminación cruzada post–elaboración en cocinas.
Esto se deduce de las pruebas epidemiológicas presentadas por Ahmed (1991), en un artículo sobre 7 brotes de salmonelosis transmitida por pescado en los Estados Unidos en el período 1978–1987. Tres de estos brotes se debieron a pescado contaminado, de los cuales, dos brotes se debieron al consumo de ostras crudas recogidas en aguas contaminadas por aguas residuales.
El género Shigella también es un miembro de las Enterobacteriaceae y está formado por 4 especies distintas. Este género está específicamente adaptado a huéspedes humanos y primates superiores, y su presencia en el medio ambiente se debe a contaminación fecal. Se ha publicado que las cepas de Shigella sobreviven hasta 6 meses en agua (Wachsmuth y Morris 1989).
La Shigella ocasiona una infección intestinal denominada shigelosis (antes conocida como disentería bacilar). Los síntomas varían desde la infección asintomática o diarrea leve hasta la disentería, caracterizada por: heces sanguinolentas, secreción mucosa, deshidratación, fiebre alta y fuertes calambres abdominales. El período de incubación de la shigelosis es de 1– 7 días y los síntomas pueden durar 10–14 días o más. Es rara la muerte en adultos, pero la enfermedad en los niños puede ser grave. En los países tropicales con bajos niveles de nutrición, la diarrea por shigela es la causa de la muerte de la menos 500.000 niños cada año (Guerrant 1985).
La gran mayoría de los casos de shigelosis son causados por la transmisión directa, persona a persona, de las bacterias por la ruta oral-fecal. También es importante la transmisión por el agua, en especial donde los niveles de higiene son bajos.
No obstante, los alimentos, incluido el pescado (cóctel de gambas, ensaladas de atún), han sido el origen de un cierto número de brotes de shigelosis. En estos casos la causa ha sido casi siempre la contaminación de los alimentos, crudos o previamente cocinados, durante su preparación por un portador infectado y asintomático, con una higiene personal pobre.
E. coli es el organismo aeróbico más común en el tracto intestinal del hombre y de los animales de sangre caliente. En general, las cepas las cepas de E. coli que colonizan el tracto gastrointestinal son comensales inofensivos y juegan un papel importante en el mantenimiento de la fisiología intestinal. No obstante, dentro de la especie hay al menos 4 tipos de cepas patógenas:
| 1. | E. coli enteropatógena | (ECEP) |
| 2. | E. coli enterotoxígena | (ECET) |
| 3. | E. coli enteroinvasora | (ECEI), E. coli del tipo de la disentería shiga |
| 4. | E. coli enterohemorágica/ | (ECEH)/ |
| E. coli productora de verocitoxina | (ECVT) o E. coli 0157:H7 |
El seromarcaje, así como el marcaje por fagos y los métodos genéticos, se usan en estudios epidemiológicos para separar los distintos tipos de E. coli, pero no existe un marcador fenotípico específico para separar las cepas patógenas de las no patógenas. No obstante, algunas propiedades atípicas, como el ser lactosa-negativa o la ausencia de producción de indol a 44°C, son más comunes entre las cepas patógenas (Varnam y Evans 1991). La ECVT no se desarrolla en medios selectivos a 44°C.
Evidentemente, E. coli puede aislarse en medios contaminados por materias fecales o aguas residuales y puede además, multiplicarse y sobrevivir durante mucho tiempo en este medio (Rhodes y Kator 1988, Jiménez et al. 1989). No obstante, recientemente se ha demostrado que E. coli puede encontrarse también en aguas tropicales cálidas no contaminadas, donde puede sobrevivir indefinidamente (Hazen 1988, Fujioka et al. 1988, Toranzos et al. 1988).
Las cepas patógenas de E. coli producen enfermedades del intestino que pueden variar, en cuanto a la gravedad, desde extremadamente ligera a grave, y posiblemente mortal, dependiendo de un cierto número de factores como: el tipo de las cepas patógenas, la susceptibilidad de la víctima y el grado de exposición.
No existe ningún indicio de que el pescado sea una fuente importante de infección por E. coli (Ahmed 1991). La mayoría de las infecciones parecen estar relacionadas con la contaminación del agua o la manipulación de los alimentos en condiciones no higiénicas.
Todas las Enterobacteriaceae (Salmonella, Shigella, E. coli) están presentes en los productos pesqueros como resultado de la contaminación a partir del reservorio animal/humano. Esta contaminación normalmente se ha relacionado con la contaminación fecal o la contaminación de las aguas naturales o de los medios acuáticos, donde estos microorganismos pueden sobrevivir durante mucho tiempo (meses), o a través de la contaminación directa de los productos durante su elaboración.
Una buena higiene personal y la educación sanitaria de los manipuladores de alimentos son, por tanto, esenciales en la lucha contra las enfermedades causadas por las Enterobacteriaceae. Un tratamiento adecuado del agua (p. ej. cloración) y una red de saneamiento de aguas residuales son también parte esencial en un programa de control.
El riesgo de infección con las Enterobacteriaceae se puede minimizar o eliminar cocinando adecuadamente la comida antes de su consumo. Se admite sin ninguna duda que la resistencia al calor de Salmonella es baja, pero también que varía considerablemente con la aw y con la naturaleza de los solutos en el medio de cocción (D'Aoust 1989). Por lo tanto, se ha registrado un notable aumento de la resistencia al calor a aw bajas. En el Cuadro 3.6 se citan ejemplos de valores D en alimentos con aw, alta así como otros factores físicos que limitan el desarrollo de las Enterobacteriaceae. Por tanto, el desarrollo se inhibe en general con un 4– 5 por ciento de NaCl. A baja temperatura o bajo pH se observa un aumento de la inhibición. Se ha determinado que la actividad de agua (aw) limitante para Salmonella en caldos de cultivo es de 0, 94 (Marshall et al. 1971).
Los factores que limitan el desarrollo de Shigella y de algunas E. coli patógenas no son de importancia, debido a la baja dosis infecciosa necesaria para producir la enfermedad.
Los actuales niveles de Salmonella en diversos alimentos y la creciente tendencia de las infecciones en el hombre, así como de los brotes transmitidos por alimentos (D'Aoust 1989), subrayan que los ensayos bacteriológicos y los niveles bacteriológicos rigurosos (niveles de tolerancia cero) de la mayoría de los alimentos, son medidas insuficientes para la lucha contra la salmonelosis. Incluso la calidad microbiológica del agua de cultivo parece no ser un buen indicador de la contaminación de Salmonella, ya que ostras recogidas en bancos abiertos y cerrados tenían el mismo nivel de contaminación (4 por ciento) y no se observó ninguna correlación entre la presencia de E. coli y Salmonella (D'Aoust et al. 1980).
Los estafilococos son organismos ubicuos y se pueden encontrar en el agua, el aire, el polvo, la leche, las aguas residuales, el pavimento, otras superficies y todos los artículos que entran en contacto con el hombre, además, sobreviven muy bien en el medio ambiente. No obstante, su principal reservorio y hábitat es la nariz, garganta y piel del hombre y animales. La tasa de portadores humanos puede ser hasta del 60 por ciento de los individuos sanos, con una media del 25–30 por ciento de la población que es positiva para las cepas productoras de enterotoxinas (Ahmed 1991).
La enfermedad causada por S. aureus es una intoxicación. Los síntomas comunes, que pueden aparecer entre 2 y 4 horas después del consumo de alimentos contaminados, son náuseas, vómitos y algunas veces diarrea. Normalmente, los síntomas no duran más de 24 horas, pero en casos graves, la deshidratación puede llevar a la conmoción y al colapso.
El pescado puede ser contaminado con Staphylococcus a través de manipuladores infectados o a partir del medio ambiente. Con mayor frecuencia la contaminación procede de un individuo con una infección en las manos, con un resfriado o con dolor de garganta.
S. aureus es mesofílico, con una temperatura mínima de desarrollo de 10 °C, pero se requieren temperaturas más altas para la producción de toxinas (>15 °C). A diferencia de las Enterobacteriaceae, pero al igual que la L. monocytogenes, el S. aureus es tolerante a la sal y puede desarrollarse con actividades de agua tan bajas como 0, 86. El mínimo pH para el desarrollo es 4,5. Las necesidades mínimas anteriores se refieren al desarrollo de laboratorio, cuando el resto de los factores son óptimos. Este no siempre es el caso en los alimentos, en donde varios factores limitantes pueden estar actuando conjuntamente. También debe subrayarse que los estafilococos son malos competidores y no se desarrollan bien en presencia de otros organismos. Por lo tanto, la presencia de estafilococos en alimentos crudos contaminados de forma natural, es de poca importancia. Por el contrario, en mariscos precocinados (camarones) puede tener lugar un desarrollo rápido y una producción de toxinas si se vuelven a contaminar con S. aureus, y las condiciones de tiempo y temperatura permiten su desarrollo.
S. aureus al multiplicarse en los alimentos produce diversas enterotoxinas. En general, estas toxinas son muy resistentes a las enzimas proteolíticas y al calor. No se han registrado brotes en alimentos sometidos a procedimientos normales de enlatado, pero el calor que se aplica en la pasteurización y la cocina doméstica normal no son suficientes para destruir la toxina.
Se requieren buenas condiciones sanitarias, así como el control de la temperatura, para evitar la contaminación, la proliferación y producción de toxinas, particularmente en productos pesqueros precocidos.