Aún no se conoce la incidencia de los brotes de gastroenteritis víricas transmitidos por los alimentos, pero algunos autores creen que son bastante comunes. Los progresos en el estudio de los virus que infectan el intestino humano han sido lentos y se sabe poco sobre las características importantes de los virus entéricos. Hoy en día es posible el cultivo de algunos virus (p. ej. virus de la Hepatitis A, VHA), pero no se dispone de métodos confiables para la detección de virus en los alimentos. No obstante, se están desarrollando rápidamente técnicas basadas en la biología molecular, como las sondas ADN/ARN y las rutinas RCP (reacción en cadena de la polimerasa).
La transmisión de enfermedades virales al hombre por el consumo de pescado se conoce desde los años `50 (Roos 1956), y parece ser que la causa principal de las enfermedades transmitidas por los productos pesqueros son los virus entéricos del hombre. En la actualidad se sabe que hay más de 100 virus entéricos que son excretados en las heces humanas y que van a parar a las aguas residuales domésticas. No obstante, según Kilgen y Cole (1991) se ha demostrado que tan sólo unos pocos son los causantes de enfermedades relacionadas con productos pesqueros.
Estos virus son: Hepatitis - tipo A (VHA)
Virus Norwalk (estructura
pequeña y redonda)
Agente nieve de montaña
Calicivirus
Astrovirus
No
A y No B
Los virus son inertes fuera de la célula viva hospedante, pero sobreviven. Esto significa que independientemente del tiempo, la temperatura u otras condiciones físicas, los virus no se multiplican en el agua o en los alimentos. Su presencia en productos pesqueros es simplemente el resultado de la contaminación, bien por la vía de los manipuladores de alimentos infectados o por la vía del agua contaminada. Los moluscos bivalvos que se alimentan mediante filtración tienden a concentrar los virus del agua en la que crecen. A través de los bivalvos vivos pasan grandes cantidades de agua (según Gerba y Goyal (1978), hasta 1.500 1/día/ostra), lo que significa que la concentración del virus en el molusco es mucho más alta que en el agua circundante.
La dosis infectante de los virus necesaria para causar enfermedades transmitidas por los alimentos es probablemente mucho más pequeña que la de las bacterias (Cliver 1988). La dosis mínima infectante para el hombre de algunos virus entéricos, es cercana a la dosis mínima detectable en condiciones de laboratorio que utilizan cultivos celulares (Ward y Akin 1983).
El cuerpo humano y el de los animales constituyen la fuente de los virus entéricos. Dependiendo del virus de que se trate, al cabo de unos pocos días o varias semanas después de la ingestión/infección, los virus se encuentran en grandes cantidades en las heces de las personas infectadas. La contaminación fecal directa o indirecta es la fuente más común de contaminación de los alimentos.
Los moluscos bivalvos encabezan la lista de vehículos alimentarios en los brotes de enfermedades virales. No obstante, otro vehículo importante son las comidas precocinadas, preparadas posteriormente por manipuladores infectados. Los datos disponibles muestran que prácticamente cualquier comida que entra en contacto con las manos del hombre y posteriormente no recibe un tratamiento térmico substancial, puede transmitir estos virus.
Salvo algunas excepciones, todos los casos registrados de infecciones virales transmitidas por productos pesqueros, se han debido al consumo de moluscos crudos o poco cocidos (Kilgen y Cole 1991). No obstante, existen pruebas claras de que el VHA se ha transmitido por medio de prácticas antihigiénicas durante la elaboración, distribución o manipulación de los alimentos (Ahmed 1991). Estas enfermedades relacionadas con productos pesqueros son muy comunes. En los Estados Unidos (EE.UU.) cada año se comunican al Centro de Control de Enfermedades (Center of Disease Control - CDC) de 20 000 a 30 000 casos; de todos los notificados uno de los mayores brotes de enfermedades transmitidas por los alimentos es el brote de hepatitis que afectó a 290 000 casos en China en 1988. La investigación reveló que el origen y modalidad de transmisión fue el consumo de almejas contaminadas e insuficientemente cocidas (Tang et al. 1991).
Según Gerba (1988), la supervivencia de los virus en el ambiente y en los alimentos depende de distintos factores, entre los que se encuentran: la temperatura, la salinidad, la radiación solar y la presencia de sólidos orgánicos. Así, los virus entéricos son capaces de sobrevivir durante varios meses en el agua de mar a temperaturas < 10 °C, este período es mucho más largo que, p. ej., el de las bacterias coliformes (Melnick y Gerba 1980). Por lo tanto, no existe ninguna correlación, o hay poca, entre la presencia de virus y la bacterias indicadoras de contaminación fecal que se utilizan normalmente. Todos los virus entéricos son también resistentes al pH ácido, a las enzimas proteolíticas y a las sales biliares del intestino. El virus de la hepatitis del tipo A, uno de los virus más estables al calor, tiene un período de inactivación de 10 min. a 60 °C (Eyles 1989). Así, los virus son capaces de sobrevivir en algunas de las preparaciones culinarias realizadas normalmente (cocción al vapor, frituras). Los virus entéricos son también resistentes a algunos desinfectantes comunes (p. ej. fenólicos, compuestos de amonio cuaternario, etanol), mientras que los halógenos (p. ej. cloro, yodo) inactivan los virus entéricos en el agua y en las superficies limpias. El ozono es muy eficaz en el agua limpia (cita basada en Eyles 1989).
La prevención de las enfermedades virales transmitidas por los alimentos está basada en medidas para impedir la contaminación fecal, directa o indirecta, de los alimentos que no van a recibir un tratamiento viricida antes de su consumo.
Los moluscos bivalvos son idóneos para el consumo humano si se recolectan en aguas libres de contaminación, o bien se les transforma en idóneos mediante su depuración controlada en agua de mar limpia, o mediante cocción. Sin embargo, existen considerables problemas con respecto a los programas de depuración controlada:
El control de las áreas de recolección se ha basado en indicadores bacterianos de contaminación, que como se sabe no son predictores confiables de la contaminación (Richards 1985, Cliver 1988).
La tecnología de la depuración en algunas ocasiones puede ser insuficiente para la eliminación de los virus en los bivalvos (Eyles 1986, Gerba 1988) y no existe un ensayo práctico que indique que el molusco ha sido depurado de hecho.
La contaminación a través de los manipuladores de los alimentos puede prevenirse mediante una buena higiene personal y una educación sanitaria, como se ha mencionado en las medidas de lucha contra las enfermedades causadas por Enterobacteriaceae. Los manipuladores de alimentos no deben manejar los alimentos cuando sufren infecciones intestinales, hasta por lo menos 48 horas después de la desaparición de los síntomas. En caso de duda se deben portar guantes desechables en las operaciones críticas, dado que los virus son difíciles de eliminar de las manos por lavado y son resistentes a muchos desinfectantes de la piel (Eyles 1989).
Las biotoxinas marinas son causantes de un amplio número de enfermedades transmitidas por los productos pesqueros. Las toxinas conocidas se muestran en el Cuadro 3.7. Las toxinas, y las enfermedades que pueden producir, han sido descritas y revisadas por Taylor (1988), Hall (1991), OMS (WHO 1984a, 1989) y Todd (1993), y deben consultarse para una información más detallada. A continuación se exponen algunos de los aspectos más importantes.
| Toxina | Dónde/cuándo se produce | Animal(es)/órgano implicado |
|---|---|---|
| Tetrodotoxina | en pescado ante mortem | pez soplador (Tetraodontidae) principalmente en los ovarios, hígado, intestino |
| Ciguatera | Algas marinas | >400 especies de peces tropicales/subtropicales |
| PSP- toxina paralizante de los moluscos | Algas marinas | moluscos que se alimentan por filtración, principalmente en las glándulas digestivas y gónadas |
| DSP-toxina diarreica de los moluscos | Algas marinas | moluscos que se alimentan por filtración |
| NSP-toxina neurotóxica de los moluscos | Algas marinas | moluscos que se alimentan por filtración |
| ASP-toxina amnésica de los moluscos | Algas marinas | moluscos que se alimentan por filtración (mejillones azules) |
A diferencia del resto de las biotoxinas que se acumulan en productos pesqueros, la tetrodotoxina no es producida por las algas. El mecanismo preciso de la producción de esta toxina tan potente no está claro, pero al parecer intervienen bacterias simbióticas que están presentes con bastante frecuencia (Noguchi et al. 1987, Matsui et al. 1989).
La tetrodotoxina se encuentra fundamentalmente en el hígado, ovarios e intestino de varias especies de peces sopladores (globo), siendo los más tóxicos los miembros de la familia Tetraodontidae, aunque no todas las especies de esta familia contienen la toxina. El tejido muscular de los peces tóxicos normalmente carece de la toxina, pero existen excepciones. La intoxicación por el pez globo produce síntomas neurológicos de 10 a 45 minutos después de la ingestión. Los síntomas son sensación de hormigueo en la cara y en las extremidades, parálisis, síntomas respiratorios y colapso cardiovascular. En los casos fatales, la muerte sobreviene en menos de 6 horas.
La intoxicación por ciguatera ocurre como consecuencia de la ingestión de pescado que se ha vuelto tóxico al alimentarse de dinoflagelado tóxicos, que son algas planctónicas marinas microscópicas. La principal fuente es el dinoflagelado bentónico Gambierdiscus toxicus, que vive en las proximidades de los arrecifes coralinos fuertemente fijado a las macroalgas. Se observa un aumento de la producción de dinoflagelados tóxicos cuando los arrecifes se alteran ecológicamente (huracanes, derribo de arrecifes, etc.). En la Figura 3.3 se muestran más de 400 especies de peces, todas de aguas tropicales o cálidas, que pueden haber producido ciguatera (Halstead 1978). La toxina se acumula en los peces que se alimentan de algas tóxicas, o en carnivoros mayores que depredan a estos herbívoros. La toxina puede detectarse en el intestino, en el hígado y tejidos musculares mediante ensayos con ratones y por cromatografía. Algunos peces son capaces de eliminar la toxina de su organismo (Taylor 1988).
Aunque la incidencia de intoxicación por ciguatera comunicada en los informes es baja (Taylor 1988), se ha estimado que la incidencia mundial puede ser del orden de 50.000 casos/año (Ragelis 1984). El cuadro clínico es variable, pero el tiempo de aparición es unas pocas horas después de la ingestión de la toxina. Los sistemas gastrointestinales y neurológicos son los afectados (vómitos, diarrea, sensación de hormigueo, ataxia, debilidad). La duración de la enfermedad puede ser de 2–3 días, aunque puede prolongarse durante semanas o incluso años en los casos graves. La muerte sobreviene como consecuencia de un colapso circulatorio. Según Halstead (1978), la tasa de casos mortales es aproximadamente del 12 por ciento.
La intoxicación después del consumo de moluscos bivalvos es un síndrome que se conoce desde hace siglos, siendo la más común la parálisis tóxica por ingestión de moluscos (PSP). La PSP es causada por un grupo de toxinas (saxitoxinas y sus derivados) producidas por dinoflagelados de los géneros Alexandrium, Gymnodinium y Pyrodinium.
Históricamente, se ha asociado la PSP con las proliferaciones de dinoflagelados (> 106 células/litro) que pueden causar una coloración rojiza o amarronada del agua. No obstante, la coloración del agua puede ser causada por la proliferación de muchos tipos de especies planctónicas que no siempre son tóxicas, y no todas las proliferaciones de algas tóxicas dan color.
La proliferación dinoflagelados es una función de la temperatura del agua, luz, salinidad, presencia de nutrientes y otras condiciones ambientales. No obstante, se desconoce la naturaleza precisa de los factores que ponen en marcha un clon tóxico. La temperatura del agua debe ser > 5–8°C para que tengan lugar las proliferaciones. Si las temperaturas caen por debajo de 4°C, los dinoflagelados sobreviven en forma de quistes enterrados en las capas superiores de los sedimentos. En la Figura 3.3 se muestra la incidencia mundial de la PSP.
Los mejillones, almejas, berberechos y veneras (conchas de abanico) que se han alimentado de dinoflagelados tóxicos retienen la toxina durante períodos de tiempo variables que dependen del tipo de molusco. Algunos eliminan la toxina muy rápidamente y son tóxicos únicamente durante el momento de la proliferación, mientras que otros retienen la toxina durante un largo período, incluso año (Schantz 1984).
La PSP es una alteración neurológica y los síntomas incluyen: hormigueo, quemazón y entumecimiento de los labios y puntas de los dedos, ataxia, somnolencia y habla incoherente. En los casos graves la muerte sobreviene por parálisis respiratoria. Los síntomas se desarrollan entre 0,5 y 2 horas después de la ingestión y las víctimas que sobreviven más de 12 horas, en general, se recuperan.
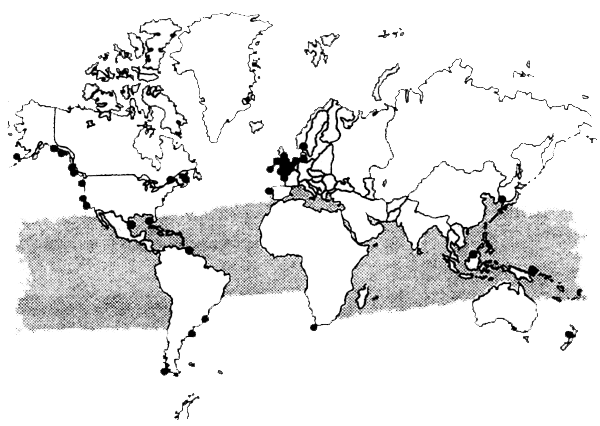
Figura 3.3 Distribución mundial de los brotes de la parálisis tóxica por ingestión de mariscos (puntos negros) y ciguatera (zona sombreada). Datos de la OMS (WHO 1984a), Halstead y Schantz (1984) y Lupin(1992).
Se ha dado parte de miles de casos de enfermedades gastrointestinales causados por la intoxicación diarreica por ingestión de moluscos bivalvos (DSP) en Europa, Japón y Chile (WHO 1984a). Los dinoflagelados causantes de la producción de las toxinas pertenecen a los géneros Dinophysis y Aurocentrum. Estos dinoflagelados están ampliamente distribuidos, lo que significa que esta enfermedad también puede producirse en otros lugares del mundo. Al menos se han identificado 7 toxinas, incluido el ácido okadoico. La aparición de la enfermedad se produce entre la media hora y unas pocas horas después del consumo del marisco que se ha estado alimentando de algas tóxicas. Los síntomas son desórdenes gastrointestinales (diarrea, vómitos, dolor abdominal) y las víctimas se recuperan en 3–4 días. Nunca se ha registrado ninguna muerte.
La intoxicación neurotóxica por ingestión de moluscos bivalvos (NSP), se ha descrito en personas que consumieron moluscos que habían estado expuestos a “mareas rojas” de dinoflagelados (Ptychodiscus breve). La enfermedad ha estado restringida al Golfo de México y otras zonas frente a la costa de Florida. Las brevetoxinas en general son muy letales para los peces y además las mareas rojas de estos dinoflagelados también están relacionadas con muertes masivas de peces. Los síntomas de la (NSP) son semejantes a los de la PSP, excepto que no tiene lugar la parálisis. La NSP rara vez es mortal.
Sólo recientemente se ha identificado la intoxicación amnésica por ingestión de moluscos bivalvos (Todd 1990, Addison y Stewart 1989). La intoxicación se debe al ácido domoico, un aminoácido producido por la diatomea Nitzschia pungens. La primera incidencia registrada de ASP tuvo lugar en el invierno de 1987/88 en el Este del Canadá donde, a raíz del consumo de mejillones azules cultivados, se vieron afectadas más de 150 personas y se produjeron 4 muertes.
Los síntomas de la ASP son muy variables, desde las náuseas ligeras y los vómitos hasta la pérdida de equilibrio y deficiencias neurales centrales, incluida la confusión y la pérdida de memoria. La pérdida de memoria a corto plazo parece ser permanente en las víctimas que sobreviven, de aquí el término intoxicación amnésica por ingestión de moluscos.
El control de las biotoxinas marinas es difícil y las enfermedades no pueden prevenirse por completo. Todas las toxinas son de naturaleza no proteica y extremadamente estables (Gill et al. 1985). Así, el cocinado, ahumado, secado o salado no las destruye, y no puede decirse por el aspecto de la carne del pescado o de los productos pesqueros, si el alimento es o no tóxico.
La principal medida preventiva es la inspección y muestreo de las zonas de pesca y de los bancos de moluscos bivalvos o poblaciones de gasterópodos, y el análisis de las toxinas. El bioensayo en ratones se utiliza a menudo para este propósito y se realiza una determinación confirmatoria por la técnica HPLC si la muerte sobreviene después de 15 minutos. Si se encuentran niveles altos de toxinas se interrumpen las capturas comerciales. Parece improbable que algún día sea posible controlar la composición del fitoplancton en las áreas de cultivo, eliminando las especies toxigénicas y además, no existe una manera fiable de predecir cuándo proliferará un tipo particular de fitoplancton y por lo tanto, no hay manera de predecir la proliferación de especies toxigénicas (Hall 1991).
La eliminación de toxinas mediante técnicas técnicas de depuración puede tener cierto potencial, pero el proceso es muy lento y costoso. Existe también el riesgo de que un número reducido de individuos se resistan a abrir y bombear agua limpia a través del sistema y de esta forma mantengan su nivel original de toxicidad (Hall 1991).
Para que el control sea eficaz se requieren planes confiables de muestreo y medios también eficaces de detección de las toxinas. En la actualidad, se dispone de métodos químicos confiables para la detección de todas las toxinas, si bien se deben perfeccionar. El plan de muestreo debe tener en cuenta que la toxicidad de los moluscos puede aumentar desde niveles insignificantes hasta letales en menos de una semana, o incluso en menos de 24 horas en mejillones azules. También la toxicidad del molusco puede variar dentro de un área de cultivo según la geografía, las corrientes de agua y la actividad de las mareas.
En el Cuadro 3.8 se presenta la situación actual en cuanto a las tolerancias y métodos de análisis que se deben utilizar en un programa de control.
| Toxina | Tolerancia | Método de análisis |
|---|---|---|
| Ciguatera | Control imposible | No existe método confiable |
| PSP | 80 ug/100 g | Bioensayo en ratones, HPLC |
| DSP | 0–60 ug/100 g | Bioensayo en ratones, HPLC |
| NSP | cualquier nivel detectable/100 g es nocivo | Bioensayo en ratones. No existe método químico |
| ASP | 20 ug/g ácido domoico | HPLC |
La intoxicación por histamina es una intoxicación química debida a la ingestión de alimentos que contienen altos niveles de histamina. Históricamente, esta intoxicación se denominó intoxicación por escómbridos debido a la frecuente asociación con peces de la Familia Scombridae, entre los que se incluyen el atún y la macarela o caballa.
La intoxicación por histamina es un problema de alcance mundial en los países donde los consumidores ingieren pescado que contiene altos niveles de histamina. Es una enfermedad benigna, su período de incubación es muy corto (de pocos minutos a pocas horas) y la duración de la enfermedad es corta (pocas horas). Los síntomas más comunes son los cutáneos, como el rubor facial o bucal, urticaria, o edema localizado, pero también puede verse afectado el tracto gastrointestinal (náuseas, vómitos, diarrea), o producirse complicaciones neurológicas (dolor de cabeza, hormigueo, sensación de quemazón en la boca).
Como se muestra en la Figura 3.4, la histamina se forma en el pescado post mortem por descarboxilación bacteriana del aminoácido histidina. Frecuentemente, los pescados afectados son aquéllos con un alto contenido natural de histidina, como los pertenecientes a la familia Scombridae, aunque también pescados distintos a los escómbridos como los de la familia Clupeidae y el mahi-mahi (dorado), pueden provocar la intoxicación por histamina.
Las bacterias productoras de histamina son ciertas Enterobacteriaceae, algunos Vibrio sp., y unos pocos Clostridium y Lactobacillus sp. Las productoras más potentes de histamina son Morganella morganii, Klebsiella pneumoniae y Hafnia alvei (Stratten y Taylor 1991). Estas bacterias pueden encontrarse en la mayoría de los pescados, probablemente como resultado de una contaminación postcaptura. Se desarrollan bien a 10 °C, pero a 5 °C el desarrollo se retarda considerablemente, y en un estudio de Klausen y Huss (1987), M. morganii no produjo histamina cuando las temperaturas eran en todo momento < 5 °C. No obstante, M. morganii producía grandes cantidades de histamina a bajas temperaturas (0–5 °C) después de estar 24 horas almacenada a altas temperaturas (10–25 °C), si bien a 5 °C o por debajo no hubo proliferación bacteriana.
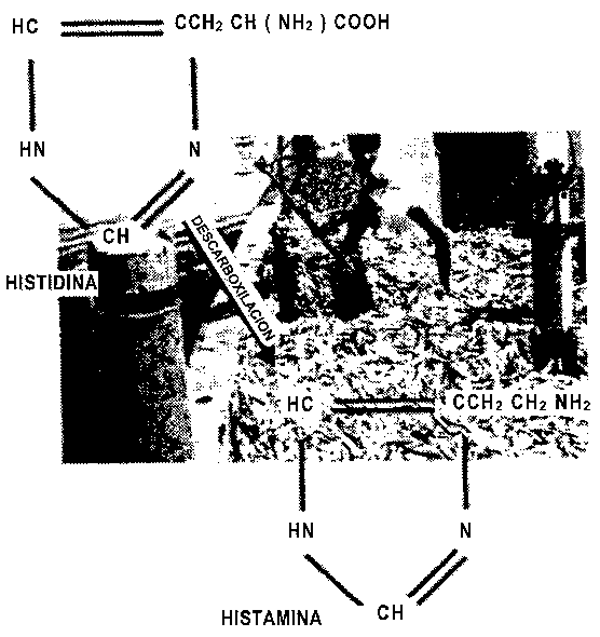
Figura 3.4. Estructura química de la histamina (fotografia: Pan y James 1985).
Muchos estudios coinciden en que las bacterias que producen histamina son mesofílicas. No obstante, Ababouch et al. (1991) encontraron una producción considerable de histamina en sardinas a temperaturas < 5 °C, y van Spreekens (1987) ha presentado un informe sobre producción de histamina por Photobacterium sp., que son también capaces de proliferar a temperaturas < 5°C.
La principal bacteria productora de histamina, M. morganii, se desarrolla mejor a pH neutro. No obstante, puede desarrollarse en un rango de pH entre 4,7 y 8,1. Este microorganismo no es muy resistente al NaCl, pero si el resto de las condiciones son óptimas la proliferación puede producirse hasta con un 5 por ciento de NaCl. Por lo tanto, la producción de histamina por este organismo es sólo un problema en productos pesqueros muy ligeramente salados.
Debe recalcarse que una vez producida la histamina en el pescado, el riesgo de que se provoque la enfermedad es muy alto. La histamina es muy resistente al calor, y aunque el pescado se haya cocido, enlatado o haya sido sometido a cualquier otro tratamiento térmico antes de su consumo, la histamina no se destruye.
La prueba de que la histamina cause o no la enfermedad es muchas veces circunstancial. Se han encontrado de forma coherente niveles altos de histamina en muestras relacionadas con brotes, y los síntomas observados en los brotes son semejantes a los de la histamina como agente causante. No obstante, una ingestión alta de histamina no siempre causa la enfermedad, incluso cuando se excede el “nivel de intervención por riesgo” (50 mg/100 g para el atún).
El cuerpo humano tolera una cierta cantidad de histamina sin ninguna reacción. La histamina ingerida será detoxificada en el tracto intestinal por al menos 2 enzimas, la diamina oxidasa (DAO) y la histamina N-metiltransferasa (HMT) (Taylor 1986). Este mecanismo de protección puede eliminarse si la ingestión de histamina y/o otras aminas biógenas es muy alta, o si las enzimas son bloqueadas por otros compuestos como se muestra en la Figura 3.5.
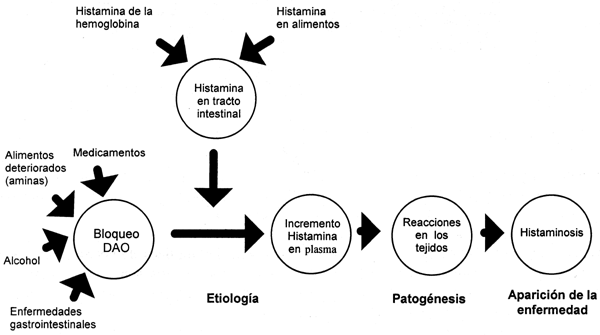
Figura 3.5. El concepto de la enfermedad de la histaminosis inducida por los alimentos (según Sattler y Lorenz 1990).
Otras aminas biógenas como la cadaverina y la putrescina, que se sabe están presentes en el pescado deteriorado, pueden actuar como potenciadores de la toxicidad de la histamina. Presumiblemente, la inhibición del catabolismo intestinal de la histamina causará un mayor transporte de la histamina a través de las membranas celulares y en la circulación sanguínea.
La medida preventiva más eficaz es una baja temperatura de preservación y almacenamiento de los productos de la pesca en todo momento. Todos los estudios parecen estar de acuerdo en que el almacenamiento a 0 °C, o muy cerca de 0°C, limita la formación de histamina en el pescado a niveles insignificantes.
Varios países han adoptado reglamentos que regulan los niveles máximos permitidos de histamina en el pescado. En el Cuadro 3.9 se muestran algunos ejemplos. Los reglamentos de la Unión Europea están publicados en la Directiva 91/493/CEE (CEE 1991b). Estados Unidos de Norte América ha establecido un doble límite: de 50 mg/100 g. como nivel de intervención por razón de riesgos y de 10 ó 20 mg/100 g. como indicador de manipulación déficiente del pescado (Stratton y Taylor 1991).
| Nivel de intervención por defecto mg/100 g | Límite máximo permitido mg/100 g | Nivel de intervención por riesgo mg/100 g | |
|---|---|---|---|
| EE.UU.(FDA) | 10–20 | - | 50 |
| UE (antes CEE) | 10 | 20 | - |
La presencia de parásitos en el pescado es muy común, pero la mayoría de ellos son de poco interés desde el punto de vista económico o de la salud pública. Se han publicado revisiones por Healy y Juranek (1979), Higashi (1985) y Olson (1987).
No obstante, se sabe que más de 50 especies de parásitos helmínticos de peces, moluscos y crustáceos pueden producir enfermedades en el hombre. La mayoría son raras y solamente ocasionan daños leves o moderados, pero algunas representan un grave riesgo para la salud. Las más importantes se enumeran en el Cuadro 3.10.
Todos los parásitos helmintos tienen ciclos vitales complicados. No se propagan directamente de pez a pez, sino que deben pasar a través de cierto número de hospedantes intermediarios en su desarrollo. Muy a menudo, los caracoles marinos o los crustáceos son los primeros hospedantes intermediarios y los peces marinos son los segundos hospedantes intermediarios, mientras que el parásito sexualmente maduro se encuentra en los mamíferos como hospedante final. Entre estos hospedantes puede transcurrir uno omás estados de vida libres. La infección en el hombre puede ser parte de este ciclo vital o puede ser un efecto secundario que provoca la interrupción del ciclo vital, como se muestra en la Figura 3.6.
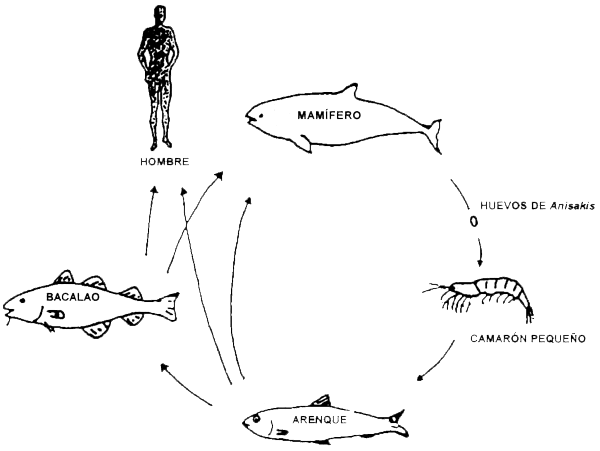
Figura 3.6 Ciclo vital de Anisakis simplex
Los nematodes son comunes y se encuentran en los peces marinos y de agua dulce de todo el mundo. Los nematodes anisakis A. simplex y P. dicipiens, conocidos vulgarmente como el gusano del arenque y el gusano del bacalao, han sido estudiados intensamente. Son nematodes típicos, de 1 a 6 cm de largo, y si el hombre los ingiere vivos pueden penetrar en la pared del tracto gastrointestinal y causar una inflamación aguda (“enfermedad del gusano del arenque”). El ciclo vital completo de Anisakis sp. se muestra en la Figura 3.6. En peces de agua dulce se puede encontrar un cierto número de otros nematodos. Gnathostoma sp. son las especies más importantes encontradas en Asia. Los hospedantes finales son el gato y el perro, pero el hombre también puede ser infestado.
Después de la ingestión, las larvas migran del estómago a diferentes zonas, normalmente a zonas subcutáneas del tórax, brazos, cabeza y cuello, donde los nematodes provocan una sensación de hormigueo y edemas.
| Parásito | Distribución geográfica conocida | Especie afectada |
|---|---|---|
| Nematodes o vermes redondos | ||
| Anisakis simplex | Atlántico Norte | arenque |
| Pseudoterranova dicipiens | Atlántico Norte | bacalao |
| Gnathostoma sp. | Asia | peces de agua dulce, ranas |
| Capillaria sp. | Asia | peces de agua dulce |
| Angiostrongylus sp. | Asia, Sudamérica, Africa | langostinos de agua dulce, caracoles, peces |
| Cestodes o vermes acintados | ||
| Diphyllobothrium latum | Hemisferio Norte | peces de agua dulce |
| D. pacificum | Perú, Chile, Japón | peces de agua salada |
| Trematodes o duelas | ||
| Clonorchis sp. | Asia | peces de agua dulce, caracoles |
| Opisthorchis sp. | Asia | peces de agua dulce |
| Metagonimus yokagawai | Lejano Oriente | |
| Heterophyes sp. | Oriente Medio, Lejano Oriente | caracoles, peces de agua dulce, peces de agua salobre |
| Paragonimus sp. | Asia, América, Africa | caracoles, crustáceos, peces |
| Echinostoma sp. | Asia | almejas, peces de agua dulce, caracoles |
Otro nematode de importancia para la salud pública es la Capillaria sp. (p. ej. Capillaria philippinensis). Los vermes adultos son parásitos intestinales de los pájaros piscívoros y los huéspedes intermediarios son pequeños peces de agua dulce. La infestación en el hombre causa diarreas graves y hasta la muerte por deshidratación. Un nematode bien conocido y común en Asia es el Angiostrongylus sp. (p. ej. Angiostrongylus cantonensis). El verme adulto se encuentra en los pulmones de las ratas y los hospedantes intermediarios son los caracoles, los langostinos de agua dulce y los gecarcinos (cangrejos de tierra). Se ha demostrado que el parásito causa meningitis en el hombre (Figura 3.7).

Figura 3.7. Ciclo vital de un angiostrongílido. Se representa el ciclo vital de Angiostrongylus sp. Los nematodes, sexualmente dioicos, se acoplan y producen huevos que salen con las heces o eclosionan en el intestino. A. cantonensis alcanza la madurez en los pulmones y A. costaricensis alcanza la madurez en el intestino. Las larvas migran en zonas húmedas y pueden invadir a invertebrados como los gasterópodos. Los mamíferos pueden adquirir larvas infestantes por el consumo de invertebrados u hortalizas infestadas poco cocidas. En los mamíferos, las larvas atraviesan el intestino y migran en las vísceras. A. cantonensis migra a través del espacio subaracnoide y se desarrolla antes de migrar a los pulmones. En el hombre, las larvas no migran más allá del cerebro. A. cantonensis migra a las vísceras, músculos y piel antes de volver al intestino de las ratas. En el hombre continúa migrando hasta que muere. El ciclo vital de los gnathostomátidos es semejante, parece que infestan y migran en casi cualquier hospedante intermediario, pero solamente maduran en aquél que proporciona la señal fisiológica adecuada (según Brier 1992).
Se sabe que sólo unos pocos cestodes o tenias del hombre son transmitidos por los peces. No obstante, la “tenia ancha de los peces”, Diphyllobothrium latum, es un parásito común que alcanza hasta 10 m o más de longitud en el tracto intestinal del hombre. Este parásito emplea un microcrustáceo como primer huésped intermediario y los peces de agua dulce como segundo huésped intermediario (Figura 3.8). La especie afín (D. pacificum) es transmitida por los peces marinos y normalmente se encuentra en las regiones costeras de Perú, Chile y Japón, donde generalmente se consumen platos preparados en base a pescado crudo (ceviche, sushi y otras).
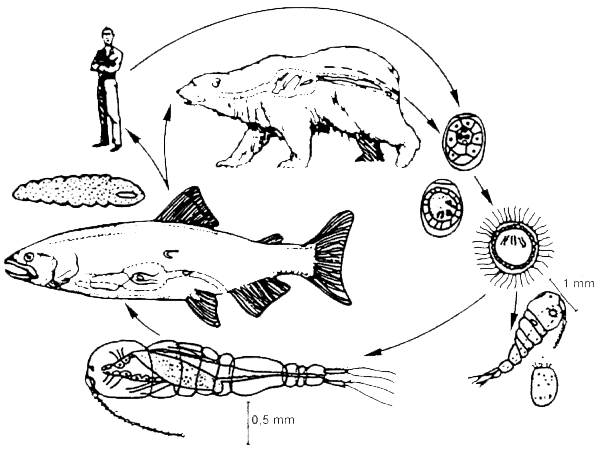
Figura 3.8. Ciclo vital de la “tenia ancha” de los peces. Diphyllobothrium sp. alcanza la madurez sexual en el tracto intestinal de los mamíferos. Los huevos pueden pasar a las heces y desarrollarse en el agua en larvas que eclosionan y nadan libremente. Si son consumidas por un copépodo u otro crustáceo adecuado como huésped, las larvas pueden volverse infestantes para los peces que consumen el crustáceo. En tal caso, estas larvas se desarrollan a formas que pueden infestar a otros peces, donde no sufren un desarrollo posterior, o a mamíferos donde pueden alcanzar la madurez sexual (según Brier 1992).
Algunos de los Trematodes o duelas son muy comunes, en particular en Asia. Así, se ha estimado que el Clonorchis sinensis (la “duela del hígado”) infesta a más de 20 millones de personas en Asia. En el Sur de China, las tasas de clonorquiasis en el hombre pueden superar el 40 por ciento en algunas regiones (Rim 1982). Los huéspedes intermediarios son los caracoles y los peces de agua dulce, mientras que los perros, gatos, animales salvajes y el hombre son los huéspedes definitivos, en los que la duela vive y se desarrolla en los conductos biliares del hígado. El problema predominante en la transmisión es la contaminación de las aguas con una población elevada de caracoles, por heces humanas cargadas de huevos (p. ej. utilización de heces humanas como fertilizante).
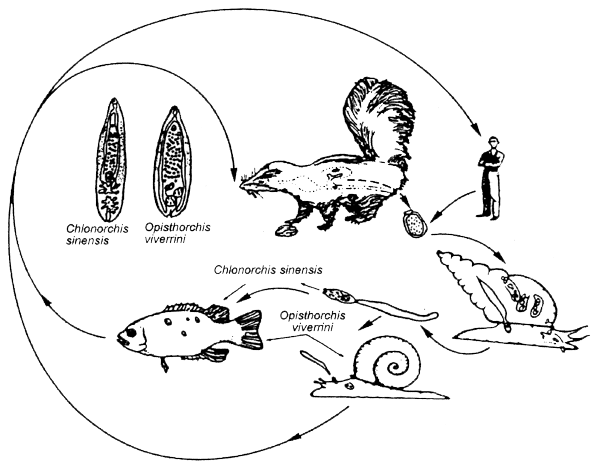
Figura 3.9. Ciclo vital de la “duela del hígado”. Estos trematodes alcanzan la madurez sexual en el hígado del hombre y de otros mamíferos. Los huevos entran en el intestino por la bilis, se incorporan a las heces del huésped y, si son ingeridos por un molusco, pueden eclosionar. Las larvas penetran en los tejidos a través de estados morfológicamente distintos que por reproducción asexual producen larvas que nadan libremente. Las larvas de Clonorchis sinensis pueden infestar sólo ciertas especies de peces, mientras que las de Opisthorchis viverrini pueden infestar como huéspedes tanto a peces como a moluscos. En estos huéspedes las larvas se vuelven infestantes para los mamíferos que consumen huéspedes intermediarios crudos o poco cocidos (Según Brier 1992).
Dos duelas muy pequeñas (1–2 mm), Metagonimus yokagawai y Heterophyes heterophies, se diferencian de Clonorchis por vivir en el intestino del huésped definitivo causando inflamación, síntomas de diarrea y dolor abdominal. Los huéspedes intermediarios son los caracoles y peces de agua dulce (Figura 3.10).
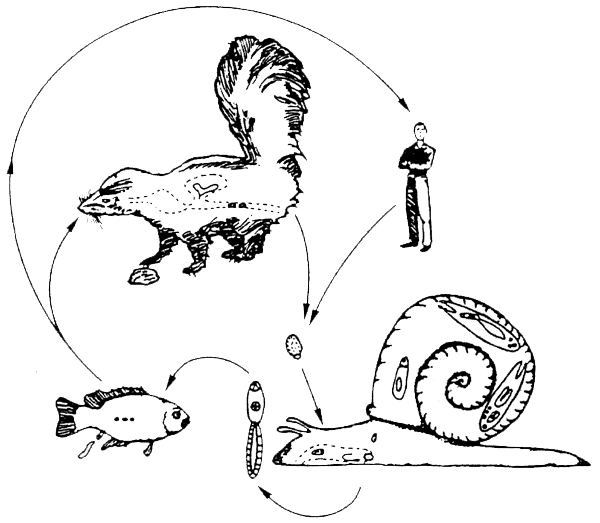
Figura 3.10. Ciclo vital de un heterófido. Las pequeñas duelas intestinales maduran sexualmente en el intestino delgado del hombre y de otros mamíferos. Maduran en zonas profundas de las vellosidades intestinales, donde algunos huevos pueden entrar en el sistema circulatorio y causar daños cardíacos. Los huevos que salen en las heces pueden transformarse en larvas que, si son consumidas por un huésped gasterópodo compatible, eclosionan y penetran en los tejidos del caracol, donde pueden desarrollarse a través de dos generaciones morfológicamente distintas. Las larvas móviles resultantes abandonan el caracol huésped y pueden penetrar en los tejidos de un pez huésped para dar lugar al estado infectivo de los mamíferos. El ciclo vital puede completarse si el hombre u otros mamíferos consumen los peces hospedantes infestados al estado crudo o poco cocido (según Brier 1992).
La duela pulmonar oriental adulta, Paragonimus sp., mide 8–12 mm y vive encapsulada en quistes en los pulmones del hombre, los gatos, perros, cerdos y muchos animales carnívoros salvajes. Los caracoles y crustáceos (cangrejo de río) son los hospedantes intermediarios (Figura 3.11).
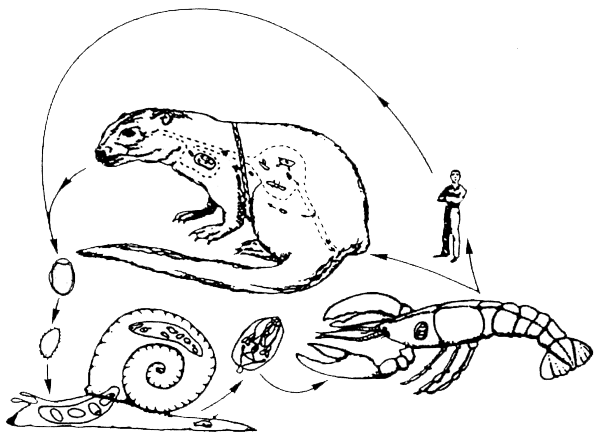
Figura 3.11. Ciclo vital de la duela del pulmón. Paragonimus sp. alcanza la madurez sexual en los pulmones del hombre y otros mamíferos, y se encuentran normalmente a pares en los sacos alveolares. Los huevos son expulsados con la tos y expelidos por medio del esputo. También se excretan en las heces. Al eclosionar los huevos, en condiciones de humedad adecuadas, salen las larvas que viven libremente. Si estas larvas encuentran, un gasterópodo hospedante pueden penetrar en su interior y desarrollarse asexualmente a través de dos formas morfológicamente distintas en larvas de vida libre. A continuación, penetran en los tejidos blandos de un cangrejo o cangrejo de río, y se encapsulan en forma infestante para los mamíferos. Las larvas consumidas por un mamífero atraviesan la pared del intestino y migran a través de los tejidos. En algunos huéspedes la migración continúa sin un desarrollo posterior. No obstante, estas larvas siguen siendo infestantes para los mamíferos que consumen hospedantes sin cocer. En los huéspedes que proporcionan la señal fisiológica adecuada, las larvas migran a los pulmones y maduran (según Brier 1992).
Todos los parásitos de interés son transmitidos al hombre cuando se alimenta de productos de la pesca crudos o sin cocinar. Las medidas de lucha para reducir los problemas de salud pública relacionados con la presencia de parásitos transmisibles incluyen la legislación y la inspección. En principio, el problema puede abordarse a tres niveles, tal como los enumera para los nematodos la OMS (WHO 1989):
Evitar la captura de peces infestados por nematodos, seleccionando áreas de pesca específicas, especies específicas o grupos de edad específicos.
Separación y eliminación del pescado infestado por nematodos, o eliminación de los nematodos del pescado, p. ej., manualmente sobre una mesa con iluminación al trasluz.
Aplicación de técnicas para destruir los nematodos en la carne de pescado.
En la pesca comercial sólo se aplican los niveles 2) y 3).
Las medidas de lucha son particularmente importantes para los productos pesqueros que se van a comer crudos o sin cocinar (arenques juveniles, pescado en escabeche, pescado ligeramente salado y pescado ahumado en frío, ceviche, sashimi, sushi, etc.). Así, muchos reglamentos sanitarios nacionales, p. ej., el decreto Alemán sobre los requisitos sanitarios para el pescado y los productos pesqueros (German Fish Ordinance 1988), contiene normas específicas para la manipulación y elaboración de este tipo de productos, para asegurar que se eliminen todos los parásitos (Procesamiento inocuo). Basados en investigaciones coordinadas entre Holanda, Alemania y Dinamarca (Huss et al. 1992), pueden darse los siguientes criterios para un procesamiento inocuo:
Pescado en escabeche:
El procesamiento inocuo se basa principalmente en el nivel de NaCl en el fluido de los tejidos. Cuando se utiliza la cantidad mínima de acético (2,5–3,0 por ciento en el fluido de los tejidos), se han determinado los siguientes tiempos máximos de supervivencia de nematodes a distintos niveles de NaCl:
| %NaCl en el fluido de los tejidos | Tiempo máximo de supervivencia de nematodes |
|---|---|
| 4–5 | > 17 semanas |
| 6–7 | 10–12 semanas |
| 8–9 | 5–6 semanas |
Los tiempos máximos de supervivencia de los nematodes serán, por tanto, el tiempo mínimo de almacenamiento del producto final antes de su venta.
Pescado tratado térmicamente:
Todos los nematodes quedan eliminados al ser calentados a 55 °C durante 1 minuto. Esto significa que el pescado ahumado en caliente, pasterizado, adobado y otros productos pesqueros ligeramente calentados son inocuos. No obstante, algunas tradiciones culinarias caseras normales pueden estar en el límite de la inocuidad.
Pescado congelado:
La congelación a -20 °C y el mantenimiento de esta temperatura al menos durante 24 horas eliminará todos los nematodes. Los resultados enumerados anteriormente muestran que varios productos pesqueros no son inocuos. Esto se aplica a los productos pesqueros salados ligeramente (< 5–6 por ciento de NaCl en la fase acuosa) como los arenques juveniles, pescado azucarado y salado, pescado ahumado en frío, caviar ligeramente salado, ceviche y diversos productos locales tradicionales. Por tanto, deberá incluirse en la elaboración un período corto de congelación, bien de la materia prima o bien del producto final, como medida de lucha contra los parásitos.
La contaminación con sustancias químicas figura en lugares muy bajos en las estadísticas oficiales como causa de enfermedades transmitidas por los productos pesqueros (véase el Cuadro 2.2).
Las sustancias químicas contaminantes con cierto potencial tóxico son (Ahmed 1991):
Sustancias químicas inorgánicas: antimonio, arsénico, cadmio, plomo, mercurio, selenio y sulfitos (utilizados en la elaboración de camarones).
Compuestos orgánicos: bifenilos policlorados, dioxinas e insecticidas (hidrocarburos clorados).
Compuestos relacionados con la elaboración: nitrosaminas y contaminantes relacionados con la acuicultura (antibióticos, hormonas).
En cualquier medio acuático limpio hay una concentración moderada de contaminantes. Unos cuantos metales como el cobre, selenio, hierro y zinc son nutrientes esenciales para los peces, moluscos y crustáceos. La contaminación tiene lugar cuando hay un aumento estadístico significativo de los niveles medios en organismos comparables.
Los problemas relativos a la contaminación química del medio ambiente son, casi todos, de origen humano. El vertido al océano de cientos de millones de toneladas de productos de desecho de las industrias transformadoras, de los lodos de las plantas depuradoras, el arrastre al mar de productos químicos utilizados en agricultura y de las aguas residuales no tratadas de los grandes núcleos urbanos y de las industrias, todo ello interviene en la contaminación de los medios marinos costeros o de las aguas continentales. A partir de aquí, las sustancias químicas encuentran una vía para ingresar a los peces y otros organismos acuáticos.
En especies predadoras pueden encontrarse cantidades cada vez mayores de sustancias químicas como resultado del bioaumento, que es la concentración de las sustancias químicas en los niveles superiores de la cadena trófica. Estas concentraciones también pueden ocurrir como resultado de la bioacumulación, cuando las concentraciones crecientes de sustancias químicas en los tejidos corporales son el resultado de la acumulación a lo largo de la vida del individuo. En este caso, un pez de mayor tamaño (de mayor edad) tendrá un contenido más alto de la sustancia química en cuestión que un pez pequeño (más joven) de la misma especie.
Por lo tanto, la presencia de contaminantes químicos en los productos pesqueros depende en gran medida de la localización geográfica, especie y tamaño (edad), hábitos de alimentación, solubilidad de las sustancias químicas y su permanencia en el medio ambiente.
En una revisión reciente sobre diversos aspectos de los residuos de sustancias químicas en los productos pesqueros, Price (1992) concluyó que el riesgo derivado de los contaminates químicos en los pescados y mariscos capturados con fines comerciales es bajo y no representa un problema. El riesgo de los residuos químicos (mercurio, selenio, PCP, kepona, clordano, dieldrin y DDT) tiene gran interés en relación a la captura deportiva de peces capturados en aguas costeras y (posiblemente) en aguas muy contaminadas.
Sin embargo, en un informe de un comité relativo a la inocuidad de los productos pesqueros en los Estados Unidos de Norte América se dedicó un extenso capítulo a la frecuencia de la contaminación química y los riesgos asociados a la salud pública (Ahmed 1991). Seguidamente se citan algunas de las conclusiones generales y recomendaciones de este informe:
Tanto a partir de fuentes naturales como del cultivo, una pequeña proporación de los productos pesqueros está contaminada con concentraciones apreciables de sustancias químicas, orgánicas e inorgánicas, potencialmente peligrosas. Algunos de los riesgos que pueden ser significativos comprenden los efectos reproductivos de los PCB y del metilmercurio, y la carcinogénesis de los productos de la familia de los PCB, las dioxinas y algunos plaguicidas hidrocarbonados clorados.
El consumo de ciertos tipos de productos pesqueros contaminados representa un riesgo elevado, por lo que deben mejorarse los esfuerzos para la evaluación y el control de dicho riesgo, y la educación al respecto.
Los procedimientos actuales de evaluación cuantitativa del riesgo utilizados por las agencias del gobierno, pueden y deben ser mejorados, y ampliados para evitar efectos cancerígenos.
Los programas actuales de control y vigilancia proporcionan una representación insuficiente de la presencia de contaminantes en la porción comestible de los productos pesqueros nacionales e importados, lo que las posibilidades específicas para su control.
Debido a la desigualdad de la contaminación entre las especies y áreas geográficas, es posible concentrar los esfuerzos para el control, y todavía lograr reducir considerablemente los riesgos.
Los bancos de datos sobre la evaluación de la inocuidad de determinadas sustancias químicas cuya vía de entrada hacia el producto es la acuicultura y la elaboración, son insuficientes para apoyar la conclusión de que estas sustancias se controlan eficazmente
Las principales recomendaciones del comité son las siguientes:
Deben reforzarse y cumplirse los reglamentos vigentes para reducir al mínimo la contaminación química y biológica del medio acuático.
Deben reforzarse y cumplirse los reglamentos vigentes de la FDA EE.UU. y de los Estados, para reducir el consumo humano de organismos acuáticos con niveles relativamente altos de contaminantes (p. ej., ciertas especies de los Grandes Lagos con elevadas concentraciones de PCB, el pez espada y otras especies con elevadas concentraciones de metilmercurio).
Las oficinas federales deben promover activamente una investigación más avanzada para determinar los riesgos actuales del consumo de contaminantes asociados con los productos pesqueros y desarrollar enfoques específicos para disminuir estos riesgos.
Debe comenzarse, a nivel estadal, un aumento del control medioambiental como parte de un sistema federal global para la gestión de riesgos.
Los Estados deben continuar ocupándose del cierre de zonas y publicar recomendaciones relativas a la contaminación, ajustadas a los hábitos de consumo específicos y a los riesgos reproductivos y a otros riesgos especiales, así como manuales de información para grupos específicos de consumidores.
Debe existir un amplio programa de educación pública sobre los riesgos de sustancias contaminantes químicas específicas, a través de las agencias de Gobierno y de los profesionales de la salud.
En el Cuadro 3.11 se muestran varios ejemplos de concentraciones máximas de residuos de sustancias químicas contaminantes en productos pesqueros para consumo humano.
| Sustancia química | Límite máximo de residuo (mg/kg.) | País |
|---|---|---|
| DDT + DDE + DDD | 2 | Dinamarca |
| Dieldrin | 0,1 | Suecia |
| PCB | 2 | Suecia |
| Plomo | 2 | Dinamarca |
| Mercurio | 0,5 | CEE |
El tejido de los peces se caracteriza por su riqueza en nitrógeno proteico y no proteico (p. ej. aminoácidos, óxido de trimetilamina (OTMA), creatinina), pero el contenido de carbohidratos es escaso, lo que origina un pH post mortem alto (> 6,0). Además, los peces pelágicos tienen un contenido alto de lípidos, que están formados principalmente por triglicéridos con ácidos grasos de cadena larga altamente insaturados.
También los fosfolípidos se hallan fuertemente insaturados y estas circunstancias tienen consecuencias importantes en los procesos de deterioro en condiciones de almacenamiento aeróbico.
La condición denominada “deterioro” no está, en términos objetivos, claramente definida. Entre los elementos evidentes del deterioro se encuentran:
detección de olores y sabores extraños
formación de exudados
producción de gases
pérdida de color
cambios de textura
y el desarrollo de estas condiciones de deterioro en el pescado y sus productos se debe a la combinación de fenómenos autolíticos, químicos y microbiológicos.
La pérdida inicial de frescura de las especies de pescado magras en su estado natural, con o sin refrigeración se debe a cambios autolíticos, mientras que el deterioro se debe principalmente a la acción bacteriana (véase la Figura 3.12).
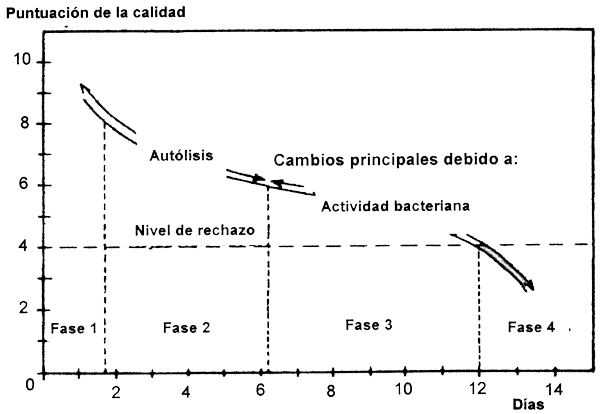
Figura 3.12 Cambios en la calidad sensorial del bacalao enfriado con hielo (0°C) (según Huss 1988).
La flora inicial del pescado es muy variada, aunque está dominada normalmente, por las bacterias psicrotróficas Gram negativas. El pescado capturado en zonas tropicales puede contener una carga ligeramente superior de organismos Gram positivos y bacterias entéricas. Durante el almacenamiento se desarrolla una flora característica, pero sólo una parte de esta flora contribuye al deterioro (véase Cuadro 3.12). Los organismos específicos del deterioro (OED) son los productores de los metabolitos que dan lugar a olores y sabores extraños relacionados con el deterioro.
Shewanella putrefaciens es típica del deterioro aeróbico en frío de muchos peces de aguas templadas, y produce trimetilamina (TMA), sulfuro de hidrógeno (SH2) y otros sulfuros volátiles que dan lugar a olores y sabores extraños sulfurosos, como los típicos olores sulfurosos de la col. Durante el deterioro a temperaturas más altas, las Vibrionaceae y Enterobacteriaceae forman metabolitos similares.
Durante el almacenamiento en atmósfera modificada (que contiene CO2), una de las principales bacterias de la alteración es una Photobacterium psicrotrofa que produce grandes cantidades de TMA. Algunos peces de agua dulce y muchos peces de aguas tropicales se caracterizan por una alteración del tipo Pseudomonas durante el almacenamiento aeróbico y refrigerado con hielo, alteración que se describe como afrutada, sulfurosa y nauseabunda.
Varios sulfuros volátiles (p. ej. metilmercaptano (CH3SH) y dimetilsulfuro (CH3)2S), a excepción del sulfuro de hidrógeno, así como varias cetonas, ésteres y aldehídos, son producidos por Pseudomonas. En el Cuadro 3.12 se muestran los OED que han sido identificados en el pescado fresco no preservado. La putrefacción avanza muy rápidamente cuando la carga de OED supera aproximadamente 107 ufc/g.
| Temperatura de almacenamiento | Atmósfera de envasado | Microflora dominate | Organismos específicos del deterioro (OED) | Referencias |
|---|---|---|---|---|
| 0°C | Aeró bica | Bacilos Gram negativos psicrotróficos, no fermentativos | S.putrefaciens | 2,3,4,9 |
| Pseudomonas sp., S. putrefaciens, Moraxella, Acinetobacter) | Pseudomonas3 | |||
| Vacío | Bacilos Gram negativos, psicrotróficos o con carácter psicrófilo | S. putrefaciens | 1,9 | |
| (S.putrefaciens, Photobacterium) | P. phosphoreum | |||
| EAM1 | Bacilos Gram negativos fermentativos con carácter psicrófilo | p. phosphoreum | 1,7 | |
| (Photobacterium) | ||||
| Bacilos Gram negativos no fermentativos psicrotróficos | ||||
| (1–10% de la flora: Pseudomonas, S. putrefaciens) | ||||
| Bacilos Gram positivos (BAL2) | ||||
| 5°C | Aeróbica | Bacilos Gram negativos psicrotróficos | Aeromonas sp. | |
| (Vibrionaceae, S. Putrefaciens) | S. putrefaciens | |||
| Vacío | Bacilos Gram negativos psicrotróficos | Aeromonas sp | ||
| (Vibrionaceae, S. putrefaciens) | S. putrefaciens | |||
| EAM | Bacilos Gram negativos psicrotróficos | Aeromonas sp | 6 | |
| (Vibrionaceae) | ||||
| 20 – 30 °C | Aeróbica | Bacilos Gram negativos mesófilos fermentativos | Aeromonas sp. móvil | 2,4,5,8 |
| (Vibrionaceae, Enterobacteriaceae) | (A. hydrophila) |
1) Envasado en atmósfera modificada (que contiene
CO2)
2) BAL = Bacterias
acidolácticas
3) En el pescado capturado en
aguas tropicales o en agua dulce suele predominar el deterioro causado por
Pseudomonas sp.
Referencias: 1) Dalgaard et al. (1993), 2) Gram
et al. (1987), 3) Lima dos Santos (1978), 4) Gram et al. (1990),
5) Gorczyca y Pek Poh Len (1985),6) Donald y Gibson (1992), 7) van Spreekens
(1977), 8) Barileet al. (1985), 9) Jørgensen y Huss (1989).
| Producto | Atmósfera de envasado | Otros preservantes distintos del NaC1 | Sintomas de deterioro | Microflora dominante | Organismos especificos del deterioro (OED)1 |
|---|---|---|---|---|---|
| Pescado ahumado en frío | Vacío | Olor/ sabor extraño (pútrido, nauseabundo, sulfuroso) | Bacilos Gram negativos (Enterobacteriaceae, Vibrionaceae) ocasionalmente BAL2 | ??? | |
| Sabor extraño (agrio, acre) | BAL | ??? | |||
| Pérdida de aroma | BAL | - | |||
| Camarones | En salmuera | Acido benzoicoy/o ácido sórbico; ácido cítrico; pH 5,5 -5,8 | Exudación | BAL | Leuconostoc sp. |
| Producción de gases ocasionalmente con olor / sabor extraño del tipo levaduras | BAL | BAL heterofermentativas, ocasionalmente levaduras | |||
| Diacetilo | BAL | BAL | |||
| - | Olor/ sabor extraño | BAL, Brochothrix | ??? | ||
| Pescado azucarado y salado (“gravad”) | Vacío | - | Olor/ sabor extraño Macarela: rancio Salmón: agrio, acre Hipogloso de Groenlandia: pútrido | BAL, Brochothrix, ocasionalmente bacterias Gram negativas (Enterobacteriaceae, Vibrionaceae, S. putrefaciens) | ??? |
| EAM | - | Olor / sabor extraño (agrio) | Bacterias Gram positivas (BAL) | ??? |
1) es decir, organismos específicos a los que se
ha atribuido el deterioro del producto
2) BAL
= Bacterias acidolácticas
La actividad microbiológica también es la causa de la alteración de muchos productos pesqueros preservados y almacenados a temperaturas > 0 °C. No obstante, en la mayoría de los casos no se conocen las bacterias específicas del deterioro. La adición de pequeñas cantidades de sal y ácido, como en los productos de pescado ligeramente preservados, cambia la microflora dominante, de manera que pasa a estar formada principalmente por especies bacterianas Gram positivas (bacterias acidolácticas, Brochotrix), y algunas de ellas pueden actuar como OED bajo ciertas condiciones como se muestra en el Cuadro 3.13. No obstante, también algunas Enterobacteriaceae y Vibrionaceae pueden actuar como OED en estos productos. Shewanella putrefaciens también puede tener cierta importancia en productos con bajos niveles de preservación.
También los productos de pescado con un mayor grado de preservación, como los productos salados o fermentados, se deterioran debido a la acción de ciertos microorganismos. La flora dominante de estos productos son los micrococos halófilos o halotolerantes Gram positivos, las levaduras, las bacterias acidolácticas formadoras de esporas y los mohos. Se sabe que varios OED son bacilos Gram negativos anaerobios, extremadamente halofílicos, así como levaduras halófilas que han sido identificados por Knøchel y Huss (1984) como organismos específicos del deterioro por causar olores y sabores extraños (sulfuroso, afrutado) en los arenques salados en húmedo.
Un tipo de bacterias del deterioro extremadamente halofílicas son las que provocan una condición conocida como “pink” (rojo/rosado). Estas bacterias (Halococcus y Halobacterium) originan una coloración rojiza/rosada en el pescado salado, en la salmuera y en la sal, así como olores y sabores extraños normalmente relacionados con el deterioro (sulfuro de hidrógeno e indol).
Algunos hongos halofílicos (Sporendonema, Oospora) también se clasifican como causantes del deterioro. No producen olores extraños, pero su presencia hace perder parte del valor comercial del producto debido a su aspecto desagradable.
Los procesos de deterioro químico más importantes son los cambios que tienen lugar en la fracción lipídica del pescado. Los procesos oxidativos conocidos como autooxidación, son reacciones en las que solamente participan el oxígeno y los lípidos insaturados. El primer paso lleva a la formación de hidroperóxidos, que son insípidos desde el punto de vista del sabor, pero pueden provocar una coloración marrón y amarilla en el músculo del pescado. La degradación de los hidroperóxidos da lugar a la formación de aldehídos y cetonas, como se muestra en la Figura 3.13. Estos compuestos tienen un fuerte sabor rancio.
La oxidación puede ser iniciada y acelerada por el calor, la luz (en especial la luz UV) y varias substancias orgánicas e inorgánicas (p. ej. Cu y Fe). También se conocen varios antioxidantes con el efecto contrario (alfa-tocoferol, ácido ascórbico, ácido cítrico, carotenoides).
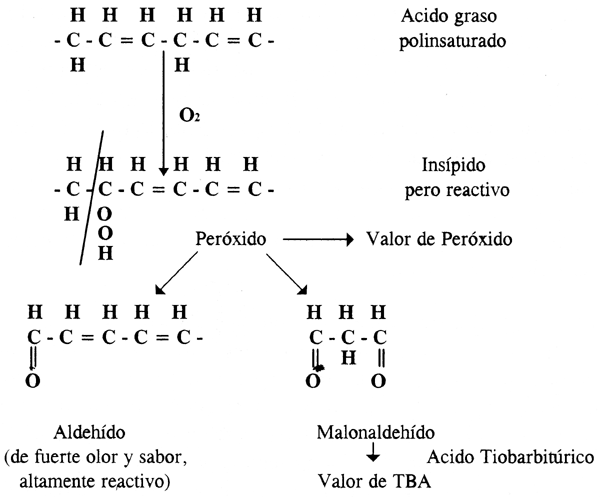
Figura 3.13 Procesos básicos en los ácidos grasos polinsturados que se encuentran en el músculo del pescado (según Ackman y Ratnayake 1992).
El deterioro autolítico o los cambios autolíticos son los que determinan las pérdidas iniciales de calidad en el pescado fresco, pero contribuyen muy poco al deterioro del pescado refrigerado o de sus productos refrigerados. Una excepción a esta afirmación es el rápido desarrollo de olores extraños y coloraciones por la acción de las enzimas intestinales en ciertos pescados no eviscerados. No obstante, en el pescado congelado los cambios autolíticos son de gran importancia. Un ejemplo es la reducción del óxido de trimetilamina (OTMA) en pescado refrigerado, por un proceso bacteriano con formación de trimetilamina (TMA). No obstante, en el pescado congelado la acción bacteriana está inhibida y el OTMA es descompuesto por la acción de enzimas autolíticas en dimetilamina (DMA) y formaldehído (FA):
(CH3)N:O → (CH3)2NH+HCHO
Los efectos del FA formado en el pescado congelado son: el aumento de la desnaturalización del músculo del pescado, cambios en la textura y la pérdida de la capacidad de retención del agua. Se cree que otras reacciones enzimáticas, tales como la formación de ácidos grasos libres, influyen significativamente en la calidad sensorial del pescado congelado. Las enzimas autolíticas son activas hasta -20°C o por debajo, pero actúan a una tasa mucho más rápida a temperaturas altas, por debajo de cero.
En el Cuadro 3.14 se resumen las causas de los diversos tipos de deterioro.
| Síntomas de deterioro | Causas del deterioro del pescado | |||
|---|---|---|---|---|
| Microbiológicas | químicas (oxidación) | autolíticas | Físicas | |
| Olores/sabores extraños | + | + | + | - |
| Formación de exudados | + | - | - | - |
| Producción de gases | + | - | - | - |
| Pérdida de color | (+) | + | + | + |
| Cambio de textura | (+) | - | + | + |
Todos los alimentos proteínicos se deterioran tarde o temprano, pero pueden tomarse diversas medidas para reducir la tasa de deterioro. La medida de mayor efecto es la de controlar la temperatura de almacenamiento. Como ya se ha mencionado, la principal causa de deterioro es bacteriana; y en el rango de temperaturas de refrigeración el patrón de desarrollo de los organismos psicrotróficos, causantes de alteración, puede describirse con exactitud mediante la expresión de la raíz cuadrada, según la revisión de Bremmer et al. (1987). Así, cuando se utiliza 0°C como temperatura de referencia, la relación entre el desarrollo (r) a una temperatura dada y el desarrollo a 0°C es:
√r=1 + 0,1 × t donde t es la temperatura en °C
Esto significa que si, p.ej., la temperatura de almacenamiento es 10°C, el desarrollo de las bacterias de alteración es 4 veces más rápido que a 0 °C (√ r =1+0,1 × 10; r=4) y la duración en almacenamiento se reduce proporcionalmente.
El deterioro químico, o desarrollo del enranciamiento, puede evitarse mediante una rápida manipulación de las capturas a bordo y el almacenamiento de los productos pesqueros en condiciones anóxicas (envasado al vacío o envasado en atmósfera modificada). Puede considerarse el uso de antioxidantes.
El efecto de la temperatura de almacenamiento sobre la calidad del pescado congelado es también considerable y la tasa de deterioro se reduce sensiblemente a temperaturas inferiores a -20 °C.
El efecto de la higiene sobre el control del deterioro varía según el tipo de contaminación que pueda tener lugar. El gran esfuerzo realizado para poder reducir la contaminación general durante la manipulación de las capturas a bordo no hizo retrasar en grado significativo el deterioro (Huss et al. 1974), puesto que sólo una parte muy pequeña de esta contaminación general se debe a bacterias específicas del deterioro. En cambio, las medidas higiénicas para evitar contaminación del pescado y sus productos por bacterias específicas del deterioro influyen fuertemente en la tasa de deterioro y la duración en almacenamiento (Jørgensen et al. 1988).