Tradicionalmente las agencias gubernamentales y la industria alimentaria han utilizado tres métodos principales para el control de los microorganismos en los alimentos según enumera la Comisión Internacional sobre Especificaciones Microbiológicas para los Alimentos ICMSF (1988). Estos son: (a) educación y formación, (b) inspección de las instalaciones y actividades y (c) ensayos microbiológicos. Estos programas se han dirigido hacia el desarrollo del conocimiento de las causas y consecuencias de la contaminación microbiana, y a la evaluación de las instalaciones, procedimientos y cumplimiento de las buenas prácticas de manipulación. Aunque éstas son partes esenciales en cualquier programa de control alimentario, tienen ciertas limitaciones y defectos. La rápida rotación del personal implica que la educación y la formación deben ser una práctica continua, lo que raramente ocurre. En lo referente a la inspección de las instalaciones y actividades, ésta a menudo se lleva a cabo siguiendo diversas directrices, tales como códigos de prácticas, leyes de control de los alimentos, etc. A menudo, estos documentos no aciertan a indicar la importancia relativa de los diversos requisitos y con frecuencia estos requisitos están expresados en términos muy imprecisos, como “satisfactorio”, “adecuado”, “aceptable”, “apropiado”, “en caso necesario”, etc. Esta falta de especificidad deja la interpretación al inspector, quien puede poner demasiado énfasis en asuntos relativamente poco importantes y así aumentar los costos sin reducir los riesgos.
Los ensayos microbiológicos también tienen algunas limitaciones como alternativa de control. Entre ellas están las limitaciones de tiempo, puesto que no se dispone de los resultados hasta varios días después de los ensayos, así como las dificultades asociadas con el muestreo, métodos analíticos y el uso de microorganismos indicadores. Estos problemas serán discutidos posteriormente con más detalle y seguidamente será descrito un enfoque diferente, dirigido a un programa preventivo de aseguramiento de la calidad.
La estimación del número de bacterias en los alimentos se utiliza con frecuencia como evaluación retrospectiva de la calidad microbiológica, o para evaluar la presunta “inocuidad” alimentaria. Este procedimiento requiere que se tomen muestras del alimento, se realicen ensayos o análisis microbiológicos y se evalúen los resultados, posiblemente por comparación con criterios microbiológicos ya establecidos. Hay serios problemas relacionados con los pasos de estos procedimientos.
El número, tamaño y naturaleza de las muestras que se toman para analizar influye enormemente sobre los resultados. En algunos casos es posible que la muestra analítica sea verdaderamente representativa del “lote” muestreado. Esto se aplica a líquidos como la leche o el agua, que pueden mezclarse suficientemente bien.
Este no es el caso de los “lotes” o “partidas” de alimentos no líquidos, dado que un lote puede estar compuesto facilmente por unidades con amplias diferencias de calidad microbiológica. Por tanto, deben considerarse varios factores antes de escoger un plan de muestreo (ICMSF 1986), a saber:
finalidad del muestreo
naturaleza del producto o lote que se va a muestrear
naturaleza del procedimiento analítico.
Un plan de muestreo (inspección por atributos) puede estar basado en indicaciones positivas o negativas de un microorganismo. Un plan así se describe con dos cifras, “n” (número de unidades de muestreo extraídas) y “c” (número máximo permitido de resultados positivos). En un plan de muestreo de atributos de 2 clases, cada unidad de muestreo se clasifica, por lo tanto, en aceptable o no aceptable. En algunos casos la presencia de un organismo (p. ej. Salmonella) será inaceptable. En otros casos se escoge un límite, denominado “m”, que separa un recuento aceptable de uno inaceptable. En el plan de muestreo de 2 clases se rechaza un “lote” si más de “c” de “n” muestras ensayadas son inaceptables.
En un plan de muestreo de 3 clases, “m” separa recuentos aceptables de recuentos marginalmente aceptables, y otra cifra “M” indica el límite entre los recuentos marginalmente aceptables y los recuentos inaceptables.
La inocuidad que puede obtenerse con estos planes de muestreo depende de las cifras que se escojan para “c” y “n”. Esto puede ilustrarse con las así llamadas curvas características operativas, que demuestran las propiedades estadísticas de tales planes (véase la Figura 4.1).
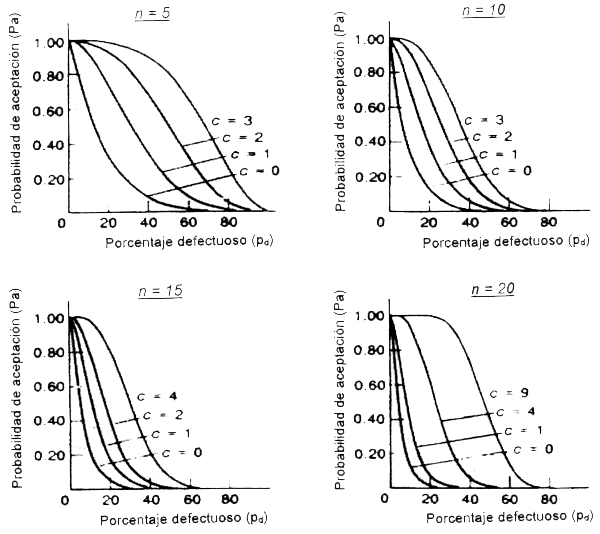
Figura 4.1 Curvas características operativas para diferentes tamaños de muestra (n) y diferentes criterios de aceptación (c), para un plan de atributos de 2 clases (ICMSF 1986).
En la Figura 4.1 se observa que cuanto mayor es el número de unidades defectuosas (Pd), más baja es la probabilidad de aceptación (Pa) de ese lote. Además, se demuestra que un valor alto de “n” y un valor bajo de “c” reducen el riesgo de aceptar lotes con el mismo número de unidades defectuosas. No obstante, incluso los más estrictos planes de muestreo utilizados no constituyen una gran garantía de inocuidad. El seguimiento de los planes de muestreo recomendados para alimentos infantiles (n = 60, c = 0) supone el ensayo de 1,5 kg. de alimento, y aún así existe un 30 por ciento de riesgo de aceptar un producto con un 2 por ciento de unidades de muestreo contaminadas con Salmonella.
Es evidente que incluso los más detallados muestreos de productos finales no pueden garantizar la inocuidad del producto en su totalidad.
Se podría decir que, aunque el muestreo y el examen de las muestras puede proporcionar poca garantía, todavía merecen la pena en aquellos casos donde no existe jurisdicción sobre las prácticas de manipulación e industrialización (como en el caso de lotes provenientes de las importaciones presentados para su admisión en puertos de entrada). Aunque solamente se encuentre una fracción de los envíos por debajo de los valores de referencia, el efecto psicológico sobre las compañías importadoras es alto.
Para aumentar la importancia del muestreo y de los ensayos, la Comisión Internacional de Especificaciones Microbiológicas para los Alimentos (ICMSF) ha introducido el concepto de relacionar la rigurosidad del plan de muestreo con el nivel de riesgo del alimento (ICMSF 1986). Así, el riesgo puede variar desde una condición de no riesgo para la salud humana pero sólo de utilidad (casos 1–3), pasando por un riesgo indirecto para la salud de nivel bajo (casos 4–6) a moderado (casos 7–12), hasta un grave riesgo directo para la salud (casos 13– 15). En caso de riesgos moderados o graves, se utiliza normalmente un plan de muestreo de atributos de 2 clases. Cuando el riesgo para la salud es bajo y en aplicación de las directrices microbiológicas, se sugiere un plan de 3 clases. Por ejemplo, un plan típico de 2 clases con n = 5 y c = 0 precisa que se ensayen 5 unidades de muestra, y el lote debería rechazarse si una de las 5 unidades de muestra es defectuosa. En el Cuadro 4.1 se muestran los planes de muestreo y los límites microbiológicos recomendados, sugeridos por la ICMSF (1986) para los productos marinos.
Los planes de muestreo para los productos pesqueros aplicados por la Administración de Alimentos y Medicamentos de los Estados Unidos de América (Food and Drug Administration, FDA) han sido examinados y evaluados por un amplio Comité para la Inocuidad de los Productos Pesqueros (Ahmed 1991). Se llegó a la conclusión de que estos planes de muestreo proporcionan relativamente poca seguridad a los consumidores y que el aumento del tamaño de la muestra no es una solución razonable. Aunque se dispusiera de métodos de ensayo completamente fiables para los microorganismos patógenos, toxinas y contaminantes químicos, está muy claro que la incertidumbre estadística asociada con el muestreo de lotes, los convierten en métodos no confiables para asegurar la inocuidad de los productos alimenticios. Por último, este Comité recomendó (Ahmed 1991) que a los proveedores de productos pesqueros para los Estados Unidos se les deberá exigir que utilicen un sistema de análisis de peligros e identificación y control de puntos críticos (HACCP) para obtener un alto nivel de garantía y un control en tiempo real a nivel de elaboración.
| Producto | Ensayo | Caso | Clase de Plan | n | c | Límite por gramo o por cm2 | |
|---|---|---|---|---|---|---|---|
| m | M | ||||||
| Pescado fresco y congelado; | APC1) | 1 | 3 | 5 | 3 | 5 × 105 | 107 |
| pescado ahumado en frío | E. coli | 4 | 3 | 5 | 3 | 11 | 500 |
| Pescado empanado precocido | APC | 2 | 3 | 5 | 2 | 5 × 105 | 107 |
| E. coli | 5 | 3 | 5 | 2 | 11 | 500 | |
| Crustáceos crudos congelados | APC | 1 | 3 | 5 | 3 | 106 | 107 |
| E. coli | 4 | 3 | 5 | 3 | 11 | 500 | |
| Crustáceos cocidos congelados | APC | 2 | 3 | 5 | 2 | 5 × 105 | 107 |
| E. coli | 5 | 3 | 5 | 2 | 11 | 500 | |
| S.aureus | 8 | 2 | 5 | 0 | 103 | - | |
| Carne de cangrejo cocida, refrigerada y congelada | APC | 2 | 3 | 5 | 2 | 105 | 106 |
| E. coli | 6 | 3 | 5 | 1 | 11 | 500 | |
| S.aureus | 9 | 2 | 5 | 0 | 103 | - | |
| Moluscos bivalvos frescos y congelados | APC | 3 | 2 | 5 | 0 | 5 × 105 | - |
| E. coli | 6 | 2 | 5 | 0 | 16 | - | |
Varios ensayos microbiológicos para el pescado y sus productos son utilizados por la industria con fines contractuales comerciales e internos de la empresa, y por las autoridades sanitarias para comprobar que el nivel microbiológico es satisfactorio. La finalidad de estos exámenes es detectar bacterias patógenas (Salmonella, V. parahaemolyticus, Staphylococcus aureus, Listeria monocytogenes, E. coli), organismos que son posibles indicadores de contaminación fecal (E. coli) u otros tipos de contaminación general o prácticas de elaboración deficientes (bacterias coliformes, estreptococos fecales, recuento de aerobios en placa-APC).
En general, los ensayos microbiológicos son costosos, llevan mucho tiempo y requieren mucho trabajo manual. No obstante, se comienza a disponer de ensayos automatizados rápidos y que están siendo acreditados, pero aún el número de muestras que se pueden examinar es limitado. Además, debe remarcarse de nuevo que un ensayo negativo para patógenos específicos en una muestra de un alimento no garantiza que el lote completo esté libre de estos patógenos. Por lo tanto, sólo puede obtenerse un grado muy limitado de inocuidad a través de los ensayos microbiológicos. Existen otras limitaciones para algunos de estos ensayos.
El Recuento total de gérmenes viables (TVC) o recuento de aerobios en placa (“Aerobic Plate Count” APC) se define como el número de bacterias (unidades formadoras de colonias por gramo = ufc/g) obtenido en óptimas condiciones de cultivo en un producto alimenticio. Por lo tanto, el TVC no es de ninguna manera, una medida de la población bacteriana “total”, sino solamente una medida de la fracción de la microflora capaz de producir colonias en el medio utilizado en las condiciones de incubación. De este modo, es bien sabido que la temperatura durante la incubación de las placas influye enormemente en el número de colonias que se desarrollan a partir de la misma muestra. Como ejemplo, el TVC puede variar en un factor de 10–100 cuando se muestrea pescado refrigerado con hielo y las placas se incuban a 20 °C y 37 °C, respectivamente. Además, el TVC no distingue entre tipos de bacterias y por lo tanto, pueden encontrarse niveles similares de TVC aunque la actividad bioquímica de las bacterias puede variar ampliamente en el alimento. También, los recuentos elevados obtenidos como resultado de la proliferación microbiana causarán defectos en los alimentos con mayor probabilidad que niveles similares originados por una contaminación grosera reciente. Por consiguiente, el TVC no tiene ningún valor en la evaluación del estado actual de la calidad sensorial.
Un TVC no tiene sentido como índice de calidad para productos de los grupos C y F (véase la sección 5.1.3), dado que normalmente en estos productos se desarrolla una gran población de bacterias acidolácticas que no producen deterioro. El TVC es de valor muy dudoso en el análisis de productos pesqueros congelados. Durante la congelación y almacenamiento frigorífico se puede producir una destrucción o daño desconocido e incontrolado de las bacterias. Por tanto, un recuento “total” muy bajo puede llevar a conclusiones falsas sobre la higiene del producto. Los ensayos de TVC pueden ser útiles para medir las condiciones de las materias primas, la eficacia de los procesos (es decir, el tratamiento térmico) y las condiciones higiénicas durante la elaboración, las condiciones sanitarias de los equipos y los utensilios, y el perfil tiempo x temperatura durante el almacenamiento y la distribución. No obstante, para que sea útil y se haga una correcta interpretación de los resultados es esencial poseer un conocimiento profundo de las condiciones de manipulación y elaboración antes del muestreo.
E.coli: El hábitat natural de este organismo es el intestino del hombre y de los animales vertebrados. En aguas templadas este organismo no se encuentra ni en el pescado ni en los crustáceos en el momento de la captura (excepto en aguas fuertemente contaminadas). Además, los productos de la pesca deben mantenerse siempre a temperaturas inferiores a las que favorecen su desarrollo. Por lo tanto, este organismo es particularmente útil como indicador de la contaminación fecal (números bajos) o de un mal manejo, como el uso de temperaturas incorrectas durante la elaboración del producto (números altos). La contaminación de los alimentos por E. coli significa riesgo de que uno o más patógenos entéricos puedan haber tenido acceso al alimento. No obstante, el no haber sido detectada E. coli no asegura la ausencia de patógenos entéricos (Mossel 1967, Silliker y Gabis 1976).
Investigaciones recientes han demostrado que pueden encontrarse E. coli y bacterias coliformes fecales en aguas tropicales cálidas no contaminadas y que la E. coli puede sobrevivir indefinidamente en este ambiente (Hazen 1988, Fujioka et al. 1988, Toranzos et al. 1988). Estos estudios también revelaron que no existía una correlación entre la presencia o ausencia de coliformes fecales, coliformes totales y virus. Así, en los trópicos, la presencia de E. coli o de coliformes fecales no es confiable como indicadora de una contaminación biológica reciente o de la descarga de efluentes de aguas residuales en el receptor acuático.
Este punto debe tomarse en consideración cuando se apliquen valores microbiológicos de referencia a los productos pesqueros de los países tropicales.
La resistencia de E. coli a condiciones fisicas y químicas adversas es baja. Esto hace que E. coli sea menos útil como organismo indicador en el análisis del agua y de los productos de pescado congelados o preservados de cualquier otra manera. Así, está bien demostrado que los virus entéricos sobreviven mucho más tiempo que E. coli en el agua de mar (Melnick y Gerba 1980) y que E. coli es menos resistente que la Salmonella en los productos congelados (Mossel et al. 1980).
Coliformes fecales: Este grupo de bacterias se utiliza a menudo en lugar de E. coli en criterios microbiológicos para evitar los ensayos confirmatorios lentos y costosos de E. coli. Estos organismos se seleccionan incubando un inóculo derivado de un caldo enriquecido en coliformes a altas temperaturas (44 °C - 45,5 °C). De esta manera, el grupo de coliformes fecales tiene una probabilidad más alta de contener organismos de origen fecal y por tanto, de indicar la contaminación fecal. Aparte de ser más rápido (y menos específico), un ensayo de coliformes fecales tiene las mismas limitaciones que las descritas para E. coli. también debe mencionarse que el E. coli 0157:H7, patógeno recientemente descrito, no se desarrolla a 44 °C en todos los medios selectivos normalmente utilizados para el recuento de E. coli (véase la sección 3.1.2).
Enterococos o estreptococos fecales: Hoy en día está bien establecido que los estreptococos fecales no son un índice confiable de contaminación fecal. Muchos alimentos y productos de la pesca contienen estos microorganismos como una parte normal de su flora, y son también capaces de establecerse y persistir en una planta de elaboración de alimentos. La mayoría son tolerantes a la sal y pueden desarrollarse a 45 °C, así como a temperaturas bajas (7–10 °C). A diferencia de E. coli son relativamente resistentes a la congelación, lo que les convierte en potencialmente útiles para evaluar la higiene de las instalaciones durante la elaboración de alimentos congelados.
Staphylococcus aureus: Este organismo está incluido en varios criterios microbiológicos. El recuento de este organismo no presenta problemas. La distribución en placa en un medio de yema de huevo Baird-Parker y la incubación durante 30 horas a 37 °C es el método más confiable. Los cultivos positivos necesitan ser confirmados mediante la prueba de la actividad de la coagulasa.
El reservorio natural de S. aureus es la piel, el pelo y las membranas mucosas superficiales (la nariz) del hombre, mientras que no forma parte de la flora normal del pescado y de sus productos. La presencia de un gran número de estas bacterias indica la posible presencia de enterotoxina y/o prácticas sanitarias o de producción defectuosas. En productos manejados por el hombre se espera una baja presencia. Debe recalcarse que S. aureus se desarrolla escasamente en competencia con un número elevado de otros organismos. Por esta razón, un ensayo para S. aureus es sólo pertinente para productos de pescado que han recibido un tratamiento bactericida, es decir, un tratamiento térmico durante la elaboración. Si se sospecha el desarrollo de S. aureus debe incluirse un ensayo para toxinas.
Un criterio microbiológico es una norma que sirve para poder realizar una comparación y evaluación de los datos propios. Un criterio microbiológico puede tener carácter obligatorio o carácter consultivo. Los diversos tipos de criterios han sido definidos por un subcomité de criterios microbiológicos establecido por el Consejo de Investigación Nacional de los Estados Unidos de Norte América (FNB/NRC 1985):
Una norma microbiológica es un criterio microbiológico que forma parte de una ley o reglamento y es un criterio obligatorio.
Una directriz microbiológica es un criterio utilizado para determinar las condiciones microbiológicas durante la elaboración, distribución y venta de los alimentos. Por consiguiente, es sobre todo un criterio consultivo.
Una especificación microbiológica es utilizada en los acuerdos de compra entre el comprador y el vendedor.
Los criterios microbiológicos pueden ser útiles en la evaluación de: la inocuidad y la duración de los alimentos almacenados, la aplicación de las buenas prácticas de manufactura (GMP: Good Manufacturing Practices) y la idoneidad de los alimentos para una determinada finalidad. Por lo tanto, los diversos criterios incluyen a menudo tanto los valores para las bacterias patógenas como para sus toxinas y organismos indicadores.
Además, el subcomité (FNB/NRC 1985) recomienda que un criterio microbiológico debe incluir los siguientes componentes:
Una frase que describa la identidad del alimento al cual se aplica el criterio.
Una frase sobre el contaminante de interés, es decir, el microorganismo o grupo de microorganismos y/o su toxina u otro agente.
El método analítico que va a utilizarse para la detección, recuento o cuantificación del contaminante de interés.
El plan de muestreo.
Los límites microbiológicos que se consideran apropiados en el alimento y proporcionales al plan de muestreo que se utilice.
Los criterios microbiológicos deben establecerse únicamente cuando existe la necesidad de hacerlo, y cuando puede demostrarse que son eficaces y prácticos. Deben considerarse diversos factores como los enumerados en el informe del FNB/NRC (1985), a saber: pruebas de un peligro, la naturaleza del producto y la microflora asociada, la forma en que finalmente se prepara para el consumo, y si se dispone de métodos de detección fiables y prácticos a un costo razonable. El establecimiento de una norma microbiológica debe considerarse solamente cuando:
Existen pruebas claras de la relación entre un alimento y los brotes de enfermedades transmitidas por alimentos, y de que la norma contribuirá a aliviar el problema.
Sobrepasar los límites es una prueba de que el alimento contiene ingredientes descompuestos, o ha sido elaborado o almacenado en condiciones más o menos deficientes.
No exista jurisdicción sobre las prácticas de elaboración y distribución (es decir, alimentos importados). La norma permitirá eliminar un riesgo para la salud y/o rechazar productos elaborados en condiciones dudosas.
Las directrices microbiológicas o valores de referencia (Mossel 1982), se establecen como consecuencia de estudios realizados durante la elaboración en varias factorías (8–10) donde se aplican las GMP. Inicialmente, se comprueban todos los detalles significativos de las GMP mediante inspección visual, métodos instrumentales o ensayos bacteriológicos. Cuando se ha comprobado que todo está en orden, se toman y examinan al menos 10 muestras en cada punto de control de cada factoría. Las curvas de distribución de los datos obtenidos se preparan y utilizan como base para el establecimiento de valores de referencia como sugiere Mossel (1982) (véase la Figura 4.2).
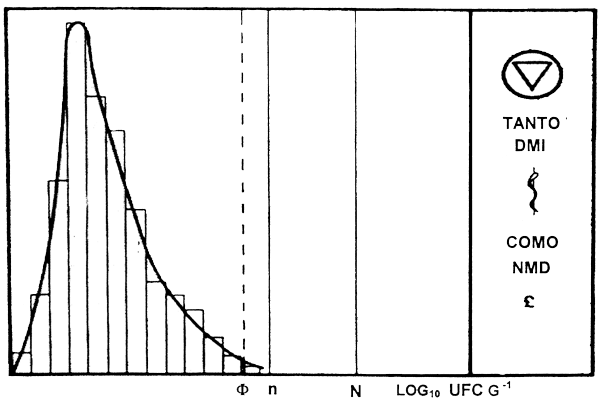
Figura 4.2 Gráfica de distribución de resultados en estudios microbiológicos de un tipo determinando de alimentos (Mossel 1982).
Φ - percentil 95to
n - valor de referencia propio
N - recuento máximo esperado en condiciones de GMP
ufc - unidades formadoras de colonias
DMI - dosis mínima infectiva
NMD - nivel mínimo de deterioro
La selección de valores para n y N puede variar en función del tipo de alimento y de la situación local. Como regla general, N es un ciclo log más alto que n y un ciclo log más bajo que DMI o NMD. Si Φ se acerca demasiado a DMI ó a NMD se precisa una mejora en las técnicas de elaboración. No obstante, se tiene que establecer una cierta tolerancia en los valores de referencia. La zona entre n y N es la zona de “alerta”, y la tolerancia usual para organismos no patógenos es que no se obtengan en este rango más de 2 muestras de cada 10, y ninguna deberá mostrar un valor de ufc/g mayor de 10 veces el valor de referencia.
Las directrices microbiológicas son útiles para determinar el grado de control durante la elaboración, y las condiciones durante la distribución y el almacenamiento. Así, las directrices microbiológicas pueden incorporarse facilmente en un sistema HACCP (véase la sección 5.1), donde resultan útiles como valores de referencia en el trabajo de vigilancia.
También, las especificaciones microbiológicas utilizadas en transacciones comerciales deben estar basadas en datos de base pertinentes y deben satisfacer una necesidad. Los criterios microbiológicos aplicados en la actualidad, al pescado y sus productos, por los miembros de la Comunidad Económica Europea junto con Canadá, Japón y Estados Unidos de Norte América (el conjunto de estos países importan más del 90 por ciento del pescado comercializado) han sido recogidos por la FAO (1989). Los ensayos exigidos se indican en el Cuadro 4.2.
Está claro que los requisitos de los criterios microbiológicos, en la forma en que se indican a continuación, no siempre se consideran en las prácticas habituales aplicadas al pescado y sus productos. La mayor parte de las normas que se indican en la circular de la FAO (1989) están incompletas, son innecesarias, no realistas y deben examinarse de nuevo. En la mayoría de los casos sólo se especifican límites microbiológicos y no se considera el resto de los componentes del criterio. Por ejemplo, una evaluación cuidadosa de todos los aspectos relacionados con los productos pesqueros frescos y congelados, elaborados para ser calentados antes de su consumo, ha dejado claro que estos productos no constituyen ningún riesgo para la salud ni un grave problema de calidad. En todo caso, el problema principal relacionado con algunos de estos productos es la posible presencia de biotoxinas. Por consiguiente, no hay necesidad o justificación para un criterio microbiológico. De forma semejante, dado que puede desarrollarse una población grande de bacterias acidolácticas inofensivas en pescados ligeramente salados y ahumados en frío, no tiene sentido establecer una norma microbiológica basada en un recuento de aerobios en placa (APC). La inclusión de recuentos de S. aureus en normas microbiológicas para productos crudos con una flora asociada grande, como ya se ha mencionado, tampoco tiene sentido (sección 4.2).
La ICMSF (1986) ha adoptado un enfoque más realista, como se muestra en el Cuadro 4.1. Solamente para los productos cocidos se recomiendan ensayos para S. aureus y, en general, se utiliza E. coli como indicador de contaminación fecal para todo tipo de productos. No obstante, la clasificación de productos del Cuadro 4.1 no es científica. El pescado ahumado en frío se clasifica junto con el pescado fresco y congelado aunque su ecología microbiológica es tremendamente diferente, mientras que los crustáceos crudos congelados forman su propio grupo aunque son microbiologicamente muy similares al pescado fresco y congelado. Se sugiere que los productos pesqueros sean agrupados como se muestra en la sección 5.1.3.
Los límites microbiológicos recomendados por la ICMSF (1986) deben ser considerados como parte de las directrices microbiológicas, y sobre todo son útiles para el control de las GMP. No obstante, existen pocas o ninguna prueba de que estos criterios hayan contribuido significativamente a la prevención de brotes de enfermedades atribuidas a estos productos. En vista de las diferencias de contaminación microbiológica del pescado y los crustáceos de diferentes partes del mundo, es dudoso que estos criterios sean de aplicación universal.
| Italia | Francia | Luxemburgo | países Bajos | Reino Unido | España | EE.UU. | Japón | |
|---|---|---|---|---|---|---|---|---|
| Pescado crudo, filetes, | 1,2,7,10,11*) | 1,3,7,10,11 | 1,2,5,6,7,10 | 1,2 | ||||
| fresco/congelado | (6) | |||||||
| Semiconservas | ||||||||
| pasteurizadas | 1,2,7,10,11 | |||||||
| no pasteurizadas | 1,2,7,10,11 | |||||||
| Salmón ahumado | 1,2,7,10,11 | |||||||
| Crustáceos | ||||||||
| crudos | 1,3,7,11 | 1,3,7,11 | 1,6,10 | |||||
| cocidos | 1,3,7,11 | 1,3,7,11 | 1,6,7,10 | |||||
| cocidos y | 1,3,7,10 | 1,3,7,10 | ||||||
| pelados | 11 | 11 | 7,10 | |||||
| Moluscos | ||||||||
| vivos | 6,7 | 3,4,7 | 3,4,7 | |||||
| crudos | 6,7 | 6,7 | 1,6,7 | 1,6 | ||||
| precocidos | 6,7 | 1,3,7,10,11 | 1,3,7,10,11 | 1,7,8,9,10 | ||||
*) Las cifras se refieren a ensayos
para:
1. Recuento de aerobios en placa
(APC)
2. Coliformes
3. Coliformes fecales
4. Estreptococos fecales
5.
Enterococos
6. E. coli
7. Salmonella
8. Shigella sp.
9.
Enterobacteriaceae totales
10.
Staphylococcus aureus
11. Bacilos
sulfito anaérobicos
En conclusión, se puede decir que no existen sistemas prácticos, basados en ensayos microbiológicos del producto final, que proporcionen inocuidad o garantía de inocuidad y una duración normal de los productos pesqueros almacenados. Los ensayos de los productos pesqueros en el “punto de ingreso” deben considerarse, en general, como un medio no eficaz de evaluación retrospectiva de las condiciones de elaboración, transporte y almacenamiento. Por esta razón, deberán utilizarse otros métodos para asegurar un grado razonable de protección, tanto del consumidor como del productor, contra los riesgos relacionados con la actividad microbiológica. Además de ser inútiles como medidas higiénicas, los criterios no pertinentes pueden tener todavía otras consecuencias al imponer costos innecesarios, introducir barreras no arancelarias al comercio e inducir a un falso sentido de seguridad.
No obstante, los criterios microbiológicos pueden ser útiles como medio de evaluar la eficacia de un programa de aseguramiento de la calidad (HACCP), en particular, como parte de un programa de verificación. Este aspecto se examinará con mayor detalle en la sección 5.1.3. Sin embargo, no puede sobreenfatizarse en que los criterios microbiológicos son por sí solos totalmente insuficientes.
El 1ro de enero de 1993 se estableció el mercado único en la Comunidad Económica Europea (ahora Unión Europea). La Directiva del Consejo de la UE 91/493/CEE (EEC 1991b) establece las condiciones sanitarias para la producción y la puesta en el mercado de los productos pesqueros. La directiva proporciona disposiciones para establecer criterios de calidad organoléptica, parásitos, controles químicos (TVB-N, histamina y contaminantes químicos) y análisis microbiológicos, incluidos los planes de muestreo y los métodos de análisis. De momento, solamente hay criterios para el contenido de histamina en el pescado (se deben tomar 9 muestras de cada partida; el valor medio no debe sobrepasar las 100 ppm, 2 muestras pueden tener un valor > 100 ppm, pero < 200 ppm, ninguna muestra puede tener > 200 ppm) y criterios microbiológicos para la carne de cangrejo y camarones cocidos y listos para el consumo, a los que se aplican las siguientes normas:
Salmonella sp. - no debe detectarse en 25 g (n = 5, c = 0)
S. aureus (ufc/g) m = 100, M = 1000 (n = 5, c = 2)
Coliformes termotolerantes (44°C) (ufc/g), m = 10, M = 100, (n = 5, c = 2) o E. coli (ufc/g), m = 10, M = 100, (n = 5, c = 1).
Véase la pág. 57 para la explicación de n, c, m y M.
Además se aplican las siguientes directrices microbiológicas al mismo producto.
Recuento total de viables (aeróbicos, 30 °C):
Producto entero: m = 10.000, M = 100.000 (n = 5, c = 2)
Productos sin cubierta o caparazón, sin incluir la carne de cangrejo: m = 50.000, M = 500.000 (n = 5, c = 2)
Carne de cangrejo: m = 100 000, M = 1.000.000 (n = 5, c = 2)
Para moluscos bivalvos vivos los requisitos se enumeran en la Directiva del Consejo de la UE 91/492/CEE de 15 de julio de 1991 (EEC 1991a) como se muestra a continuación:
Los moluscos bivalvos vivos destinados al consumo humano inmediato deben cumplir los siguientes requisitos:
Tener características visuales relacionadas con el estado vivo y la frescura, como son: conchas sin suciedad, una respuesta adecuada a la percusión y cantidades normales de líquido intravalvar.
Deben contener menos de 300 coliformes fecales, o menos de 230 E. coli, por 100 g de carne y líquido intravalvar, basado en un ensayo de NMP de 5 tubos y 3 diluciones, o cualquier otro procedimiento bacteriológico de precisión equivalente.
No deben contener Salmonella en 25 g de carne.
No deben contener compuestos tóxicos u objetables, tanto naturales como contaminantes del medio ambiente.
El límite superior en cuanto al contenido de radionucleidos no debe sobrepasar los límites establecidos por la Unión Europea para los productos alimenticios.
En las partes comestibles de los moluscos, el contenido total de toxina paralizante del marisco (PSP) no debe sobrepasar 80 μpor 100 g.
Los métodos de ensayo biológicos habituales no deben dar un resultado positivo a la presencia de la toxina diarreica del marisco (DSP) en las partes comestibles de los moluscos.
En ausencia de procedimientos de ensayo rutinarios para virus y de valores virológico de referencia, los controles sanitarios deben estar basados en recuentos de bacterias fecales.
El sistema de control de la salud pública debe comprobar, entre otras cosas, la calidad microbiológica de los moluscos bivalvos vivos, la posible presencia de plancton productor de toxinas en el agua y de biotoxinas en los moluscos. El muestreo utilizado para el control de toxinas debe llevarse a cabo en dos pasos:
Vigilancia: Muestreos periódicos organizados para detectar cambios en la composición del plancton que contiene toxinas y la consiguiente distribución geográfica. La información que lleve a una sospecha de acumulación de toxinas en la carne de los moluscos debe conllevar un:
Muestreo intensivo: Se aumenta el número de puntos de muestreo y el número de muestras, y al mismo tiempo se introducen ensayos de toxidad.