4.1 Principales constituyentes
4.2 Lípidos
4.3 Proteínas
4.4 Compuestos extractables que contienen nitrógeno
4.5 Vitaminas y minerales
La composición química de los peces varía considerablemente entre las diferentes especies y también entre individuos de una misma especie, dependiendo de la edad, sexo, medio ambiente y estación del año.
Los principales constituyentes de los peces y los mamíferos pueden ser divididos en las mismas categorías. En el Cuadro 4.1 se ilustran ejemplos de las variaciones entre ellos. La composición del músculo de la carne vacuna ha sido incluida para comparación.
Cuadro 4.1 Principales constituyentes (porcentaje) del músculo de pescado y de vacuno
|
Constituyente |
Pescado (filete) |
Carne vacuna (músculo aislado) | ||
|
Mínimo |
Variación normal |
Máximo | ||
|
Proteínas |
6 |
16-21 |
28 |
20 |
|
Lípidos |
0,1 |
0,2 - 25 |
67 |
3 |
|
Carbohidratos |
|
< 0,5 |
|
1 |
|
Cenizas |
0,4 |
1,2-1,5 |
1,5 |
1 |
|
Agua |
28 |
66-81 |
96 |
75 |
FUENTES: Stansby, 1962; Love, 1970
Como se evidencia en el Cuadro 4.1, una variación normal substancial se observa en los constituyentes del músculo de pescado. Los valores máximos y mínimos son casos extremos y se encuentran raramente.
Las variaciones en la composición química del pez están estrechamente relacionadas con la alimentación, nado migratorio y cambios sexuales relacionados con el desove. El pez tiene períodos de inanición por razones naturales o fisiológicas (como desove o migración) o bien por factores externos como la escasez de alimento. Usualmente el desove, independientemente de que ocurra luego de largas migraciones o no, requiere mayores niveles de energía. Los peces que tienen energía almacenada en la forma de lípidos recurrirán a ella. Las especies que llevan a cabo largas migraciones antes de alcanzar las zonas específicas de desove o ríos, degradarán -además de los lípidos- las proteínas almacenadas para obtener energía, agotando las reservas tanto de lípidos como de proteínas, originando una reducción de la condición biológica del pez. En adición, muchas especies generalmente no ingieren mucho alimento durante la migración para el desove y por lo tanto no tienen la capacidad de obtener energía a través de los alimentos.
Durante los períodos de intensa alimentación, el contenido de proteínas del músculo aumenta hasta una extensión que depende de la cantidad de proteína agotada; por ejemplo con relación a la migración por el desove. Posteriormente, el contenido de lípidos muestra un marcado y rápido aumento. Después del desove el pez recobra su comportamiento de alimentación y generalmente migra hasta encontrar fuentes adecuadas de alimento. Las especies que se alimentan de plancton, como el arenque, experimentan una variación estacional natural dado que la producción de plancton depende de la estación.
La fracción lipídica es el componente que muestra la mayor variación. A menudo, dentro de ciertas especies la variación presenta una curva estacional característica con un mínimo cuando se acerca la época de desove. La Figura 4.1 muestra la variación característica del arenque del Mar del Norte (4.1a) y de la caballa (4. 1b).
Figura 4.1 Variación estacional en la composición química de: (a) arenque (Clupea harengus) y (b) filetes de caballa (Scomber scombrus). Cada punto es el valor medio de ocho filetes.
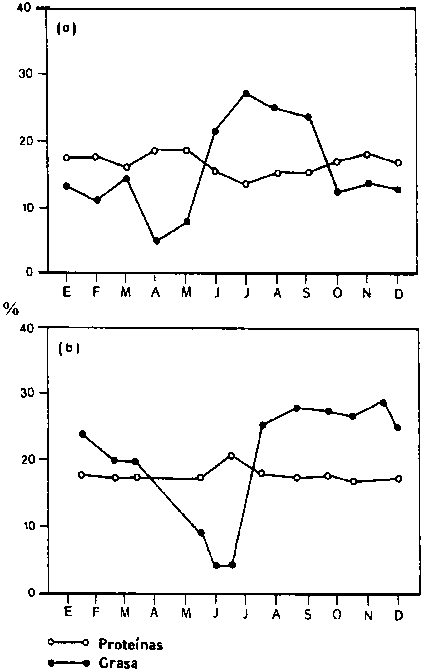
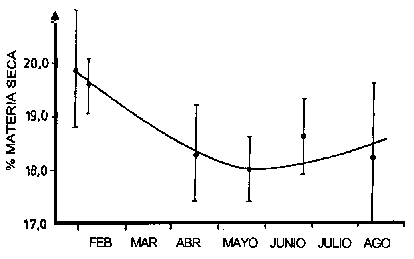
A pesar de que la fracción proteica es bastante constante en la mayoría de las especies, se han observado variaciones, como la reducción de proteínas en salmón durante largas migraciones por desove (Ando et al., 1985 b; Ando y Hatano, 1986) y en el bacalao del Báltico durante la estación de desove, que para estas especies se extiende desde enero hasta junio/julio (Borresen, 1992). La variación en el último caso se ilustra en la Figura 4.2.
Figura 4.2 Variación en el porcentaje de materia seca en músculo de bacalao del Báltico. Las barras verticales representan la desviación estándar de la media (Borrensen, 1992).
Algunas especies tropicales presentan una marcada variación estacional en su composición química. El sábalo del Oeste africano (Ethmalosa dorsalis) muestra una variación en el contenido de grasa del 2-7 por ciento (peso húmedo) durante el año, con un máximo en el mes de julio (Watts, 1957). La corvina (Micropogon furnieri) y el "pescada-foguete" (Marodon ancylodon) capturados en la costa brasileña, presentaron contenidos de grasa del 0,2 - 8,7 por ciento y 0,1 - 5,4 por ciento, respectivamente (Ito y Watanabe, 1968). También se ha observado que el contenido de grasa de estas especies varía con el tamaño, así los peces grandes contienen cerca del 1 por ciento más de grasa que los pequeños. Watanabe (1971) analizó pescados de agua dulce de Zambia y encontró una variación del 0,1 - 0,5 por ciento en el contenido de grasa de cuatro especies, incluyendo las pelágicas y las demersales.
Un posible método para distinguir entre las especies de pescado magro y las especies grasas, es denominar como especies magras aquellas que almacenan lípidos sólo en el hígado y como especies grasas las que almacenan lípidos en células distribuidas en otros tejidos del cuerpo. Las típicas especies magras son peces que habitan en el fondo acuático, como el bacalao, el carbonero y la merluza. Las especies grasas incluyen los pelágicos como el arenque, la caballa y la sardineta. Algunas especies almacenan lípidos solo en limitadas partes de sus tejidos corporales o en menor cantidad que las especies grasas típicas, y en consecuencia son denominadas especies semi-grasas (como por ejemplo la barracuda, la lisa y el tiburón).
El contenido de lípidos en filetes de pescado magro es bajo y estable, mientras que el contenido de lípidos en filetes de especies grasas varía considerablemente. Sin embargo, la variación en el porcentaje de grasas se refleja en el porcentaje de agua, dado que la grasa y el agua normalmente constituyen el 80 por ciento del filete. Esta proporcionalidad se puede emplear para "estimar" el contenido de grasa, a partir de la determinación del contenido de agua en el filete. De hecho, este principio ha sido utilizado con mucho éxito en un instrumento analizador de grasas denominado Medidor Torry de Grasas en Pescado, el cual en realidad mide el contenido de agua (Kent et al., 1992).
El contenido de grasa en el pescado, independientemente de que sea magro o graso, tiene consecuencias sobre las características tecnológicas post mortem. Los cambios que ocurren en el pescado magro fresco pueden ser anticipados mediante el conocimiento de las reacciones bioquímicas en la fracción proteica, mientras que en las especies grasas deben incluirse los cambios en la fracción lipídica. Las implicaciones pueden ser una reducción en el tiempo de almacenamiento debido a la oxidación lipídica, o deberán tomarse precauciones especiales para evitar este problema.
En el Cuadro 4.2 se muestran las variaciones en el contenido de agua, lípidos y proteínas de varias especies de pescados.
Cuadro 4.2 Composición química de los filetes de varias especies de pescados
|
Especie |
|
Nombre científico |
Agua (%) |
Lípidos (%) |
Proteínas (%) |
Energía (kJ/100g) |
|
Bacaladilla |
a) |
Micromesistius poutassou |
79-80 |
1,9-3,0 |
13,8-15,9 |
314-388 |
|
Bacalao |
a) |
Gadus morhua |
78-83 |
0,1-0,9 |
15,0-19,0 |
295-332 |
|
Anguila |
a) |
Anguilla anguilla |
60-71 |
8,0-31,0 |
14,4 |
|
|
Arenque |
a) |
Clupea harengus |
60-80 |
0,4-22,0 |
16,0-19,0 |
|
|
Solla |
a) |
Pleuronectes platessa |
81 |
1,1-3,6 |
15,7-17,8 |
332-452 |
|
Salmón |
a) |
Salmo salar |
67-77 |
0,3-14,0 |
21,5 |
|
|
Trucha |
a) |
Salmo trutta |
70-79 |
1,2-10,8 |
18,8-19,1 |
|
|
Atún |
a) |
Thunnus spp. |
71 |
4,1 |
25,2 |
581 |
|
Cigala |
a) |
Nephrops norvegicus |
77 |
0,6-2,0 |
19,5 |
369 |
|
Pejerrey |
b) |
Basilichthys bornariensis |
80 |
0,7-3,6 |
17,3-17,9 |
|
|
Carpa |
b) |
Cyprinus carpio |
81,6 |
2,1 |
16,0 |
|
|
Sábalo |
c) |
Prochilodus platensis |
67,0 |
4,3 |
23,4 |
|
|
Pacu |
c) |
Colossoma macropomum |
67,1 |
18,0 |
14,1 |
|
|
Tambaqui |
c) |
Colossoma brachypomum |
69,3 |
15,6 |
15,8 |
|
|
Chincuiña |
c) |
Pseudoplatystoma tigrinum |
70,8 |
8,9 |
15,8 |
|
|
Corvina |
c) |
Plagioscion squamosissimus |
67,9 |
5,9 |
21,7 |
|
|
Bagre |
c) |
Ageneiosus spp. |
79,0 |
3,7 |
14,8 |
|
FUENTES:
a) Murray y Burt, 1969,
b) Poulter y Nicolaides, 1985a,
c) Poulter y Nicolaides, 1985b
El contenido de carbohidratos en el músculo de pescado es muy bajo, generalmente inferior al 0,5 por ciento. Esto es típico del músculo estriado, en el cual los carbohidratos se encuentran en forma de glucógeno y como parte de los constituyentes químicos de los nucleótidos. Estos últimos son la fuente de ribosa liberada como una consecuencia de los cambios autolíticos post mortem.
Como se demostró anteriormente, la composición química de las diferentes especies de pescados muestra diferencias dependiendo de la estación del año, comportamiento migratorio, maduración sexual, ciclos alimenticios, entre otros. Estos factores son observados en peces silvestres, del mar abierto y de aguas continentales. Los peces criados en acuicultura también pueden mostrar variaciones en la composición química, pero en este caso varios factores son controlados y por lo tanto se puede predecir la composición química. Hasta cierto punto el acuicultor tiene la posibilidad de diseñar la composición del pez, seleccionando las condiciones de cultivo. Se ha reportado que factores como la composición del alimento, ambiente, tamaño del pez y rasgos genéticos, tienen un impacto en la composición y la calidad del pescado de acuicultura (Reinitz et al., 1979).
Se considera que el factor de mayor impacto en la composición química del pez es la composición de su alimento. El acuicultor esta interesado en hacer crecer el pez lo más rápido posible empleando la menor cantidad de alimento, dado que el alimento constituye el mayor componente del costo en acuicultura. El potencial de crecimiento es mayor cuando el pez es alimentado con una dieta rica en lípidos, para propósitos energéticos, y alto contenido de proteínas con una composición balanceada de aminoácidos.
Sin embargo, la cantidad de lípidos que pueden ser metabolizados con relación a la proteína, está limitada por el patrón del metabolismo básico del pez. Dado que, dentro de la composición del alimento las proteínas resultan más costosas que los lípidos, numerosos experimentos han sido llevados a cabo con el fin de sustituir la mayor cantidad posible de proteínas por lípidos. Entre la literatura que puede ser consultada se encuentra la siguiente: Watanabe et al., 1979; Watanabe, 1982; Wilson y Halver, 1986; y Watanabe et al., 1987).
Generalmente, muchas especies de peces usan algo de la proteína para propósitos energéticos independientemente del contenido de lípidos. Cuando el contenido de lípidos excede el nivel máximo que puede ser metabolizado para propósitos energéticos, el remanente es depositado en los tejidos, dando como resultado un pescado con muy alto contenido de grasa. Apartando el hecho del impacto negativo en la calidad general del pescado, el exceso de grasa también puede ocasionar disminución del rendimiento, pues los excedentes de grasa son depositados en la cavidad ventral y de este modo son descartados como desperdicio después de la evisceración y fileteado.
La vía normal para reducir el contenido de grasa en el pescado de acuicultura, antes de la cosecha, es privar al pez de alimento por un tiempo. Se ha demostrado tanto para especies magras como grasas, que esto afecta el contenido de lípidos (véase Reinitz, 1983; Johansson y Kiessling, 1991; Lie y Huse, 1992).
Debe mencionarse que el mantener el pez en cautiverio bajo condiciones controladas, además de brindar la posibilidad - dentro de ciertos limites - de predeterminar la composición del pez en las operaciones de acuicultura, también ofrece la posibilidad de conducir experimentos en los cuales se inducen las variaciones en la composición química observadas en el pez silvestre. Los experimentos pueden ser diseñados para elucidar los mecanismos que originan las variaciones observadas en los peces silvestres.
Los lípidos presentes en las especies de peces óseos pueden ser divididos en dos grandes grupos: los fosfolípidos y los triglicéridos. Los fosfolípidos constituyen la estructura integral de la unidad de membranas en la célula, por lo tanto, a menudo se le denomina lípidos estructurales. Los triglicéridos son lípidos empleados para el almacenamiento de energía en depósitos de grasas, generalmente dentro de células especiales rodeadas por una membrana fosfolipídica y una red de colágeno relativamente débil. Los triglicéridos son a menudo denominados depósitos de grasa. Algunos peces contienen ceras esterificadas como parte de sus depósitos de grasa.
El músculo blanco de un pez magro típico como el bacalao, contiene menos del 1 por ciento de lípidos. De este porcentaje, los fosfolípidos constituyen el 90 por ciento (Ackman, 1980). La fracción fosfolipídica en el pescado magro consiste en un 69 por ciento de fosfatidil-colina, 19 por ciento de fosfatil-etanolamina y 5 por ciento de fosfatidil-serina. Adicionalmente, existen otros fosfolípidos pero en cantidades inferiores.
Todos los fosfolípidos se encuentran almacenados en las estructuras de la membrana, incluyendo la membrana celular, el retículo endoplasmático y otros sistemas tubulares intracelulares, como también en membranas de los organelos como las mitocondrias. Además de fosfolípidos, las membranas también contienen colesterol, que contribuye a la rigidez de la membrana. En el tejido muscular de pescados magros se puede encontrar colesterol hasta en un 6 por ciento del total de los lípidos. Este nivel es similar al encontrado en los músculos de mamíferos.
Según se explicó anteriormente, las especies de pescado pueden ser clasificadas en magras o grasas dependiendo de como almacenan los lípidos de reserva energética. Los pescados magros usan el hígado como su depósito de energía y las especies grasas almacenan lípidos en células grasas en todas partes del cuerpo.
Las células grasas -que constituyen los depósitos de lípidos en las especies grasas- están localizadas generalmente en el tejido subcutáneo, en los músculos del vientre y en los músculos que mueven las aletas y la cola. En algunas especies que almacenan cantidades extraordinariamente elevadas de lípidos, la grasa también puede ser depositada en la cavidad ventral. Dependiendo de la cantidad de ácidos grasos poliinsaturados, la mayor parte de las grasas en el pescado son más o menos líquidas a baja temperatura.
Finalmente, los depósitos de grasa también se encuentran esparcidos por toda la estructura muscular. La concentración de células grasas parece ser más elevada cerca de las miocomatas y en las regiones entre el músculo blanco y el oscuro (Kiessling et al., 1991). El músculo oscuro contiene algunos triglicéridos dentro de las células musculares, incluso en peces magros, dado que este músculo es capaz de metabolizar directamente lípidos para la obtención de energía. Las células del músculo claro dependen del glucógeno como fuente de energía para el metabolismo anaeróbico.
En el músculo oscuro las reservas de energía son catabolizadas completamente a CO2 y agua, mientras en el músculo claro se forma ácido láctico. La movilización de energía es mucho más rápida en el músculo claro que en el oscuro, pero la formación de ácido láctico genera fatiga, dejando el músculo incapacitado para trabajar por largos períodos a máxima velocidad. De esta forma, el músculo oscuro es usado para actividades de nado continuo y el músculo claro para movimientos súbitos como cuando el pez está a punto de atrapar una presa o para escapar de un depredador.
En la Figura 4.3, se muestra un ejemplo de la variación estacional del contenido de grasa en la caballa y el capelán, apreciándose que el contenido de lípidos entre los diferentes tejidos varía considerablemente. Los lípidos almacenados son usados típicamente durante las largas migraciones del desove y durante el desarrollo de las gónadas (Ando et al., 1985a). La movilización de los lípidos para los propósitos señalados genera diferentes preguntas, como por ejemplo, si los diferentes ácidos grasos presentes en los triglicéridos son utilizados selectivamente. Aparentemente, este no es el caso del salmón, pero en el bacalao se ha observado una utilización selectiva del C22:6 (Takama et al., 1985).
Figura 4.3 Distribución de la grasa total en distintas partes del cuerpo de la caballa (parte superior) y el capelán (parte inferior) de origen noruego (Lohne, 1976).
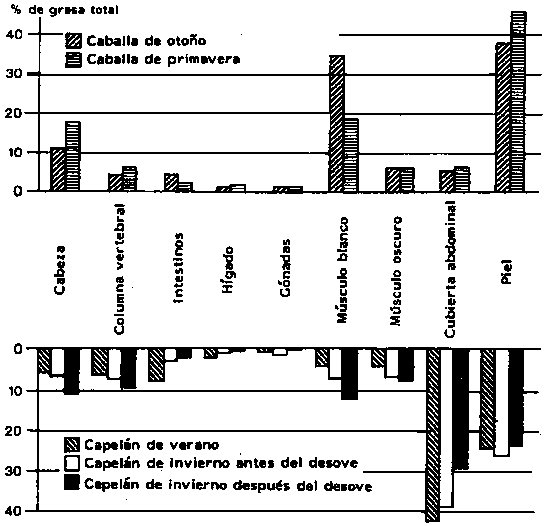
Los fosfolípidos también pueden ser parcialmente movilizados durante migraciones ininterrumpidas (Love, 1970), a pesar de que esta fracción lipídica se considera más de reserva que los triglicéridos.
En elasmobranquios, como el tiburón, una cantidad significativa de los lípidos es almacenada en el hígado y puede estar constituida por éteres alquílicos de los acilglicéridos o por el hidrocarburo escualeno. Algunos tiburones contienen un mínimo del 80 por ciento de los aceites del hígado como sustancias insaponificables, principalmente en la forma de escualeno (Buranudeen y Richards-Rajadurai, 1986).
Los lípidos de los peces difieren de los lípidos de los mamíferos. La principal diferencia radica en que están compuestos por ácidos grasos de cadena larga (14-22 átomos de carbono) con un alto grado de instauración. Los ácidos grasos de los mamíferos raramente contienen más de dos dobles enlaces por molécula mientras que los depósitos grasos del pez contienen muchos ácidos grasos con cinco o seis dobles enlaces (Stansby y Hall, 1967).
El porcentaje total de ácidos grasos poliinsaturados con cuatro, cinco o seis dobles enlaces es levemente menor en los lípidos de peces de agua dulce (aproximadamente 70 por ciento) que en los lípidos de peces de agua de mar (aproximadamente 88 por ciento) (Stansby y Hall, 1967). Sin embargo, la composición de lípidos no es completamente fija sino que puede variar un poco con la alimentación del animal y la estación del año.
En la nutrición del hombre, algunos ácidos como el linoleico y linolénico se consideran esenciales pues no son sintetizados por el organismo. En los peces estos ácidos grasos solamente constituyen alrededor del 2 por ciento del total de lípidos, un porcentaje pequeño comparado con muchos aceites vegetales. Sin embargo, los aceites de pescado contiene otros ácidos grasos poliinsaturados que pueden curar las enfermedades de la piel del mismo modo que el ácido linoleico y el ácido araquidónico. Como miembros de la familia del ácido linolénico (primer doble enlace en la tercera posición w -3, contando desde el grupo metilo terminal), también favorecen el crecimiento de los niños. De estos ácidos grasos, el ácido eicosapentaenoico (C20:5w 3) ha sido objeto recientemente de considerable atención por parte de algunos científicos daneses, quienes encontraron este ácido en la sangre y régimen alimenticio de un grupo de esquimales de Groenlandia, virtualmente libres de ateroesclerosis. Investigadores ingleses han documentado que el ácido eicosapentaenoico es un factor antitrombótico extremadamente potente (Simopoulos et al., 1991).
Las proteínas del músculo del pez se pueden dividir en tres grupos:
1 Proteínas estructurales (actina, miosina, tropomiosina y actomiosina), que constituyen el 70-80 por ciento del contenido total de proteínas (comparado con el 40 por ciento en mamíferos). Estas proteínas son solubles en soluciones salinas neutras de alta fuerza iónica (³ 0,5 M).2. Proteínas sarcoplasmáticas (mioalbúmina, globulina y enzimas), que son solubles en soluciones salinas neutras de baja fuerza iónica (0,15 M). Esta fracción constituye el 25-30 por ciento del total de proteínas.
3. Proteínas del tejido conectivo (colágeno), que constituyen aproximadamente el 3 por ciento del total de las proteínas en teleósteos y cerca del 10 por ciento en elasmobranquios (comparado con el 17 por ciento en mamíferos).
Las proteínas estructurales conforman el aparato contráctil responsable de los movimientos musculares según lo explicado en la Sección 3.2. La composición de aminoácidos es aproximadamente la misma que en las correspondientes proteínas del músculo de mamíferos, a pesar de que las propiedades físicas pueden ser ligeramente diferentes. El punto isoeléctrico (pI) está alrededor del pH 4.5-5.5. A estos valores de pH las proteínas presentan su menor solubilidad, según se ilustra en la Figura 4.4.
La estructura conformacional de las proteínas de los peces es fácilmente modificada mediante cambios en el ambiente físico. La Figura 4.4 muestra como cambian las características de solubilidad de las proteínas miofibrilares después de una congelación/deshidratación. Tratamientos con altas concentraciones salinas o calor pueden ocasionar la desnaturalización, causando cambios irreversibles en la estructura nativa de la proteína.
Cuando las proteínas son desnaturalizadas bajo condiciones controladas, sus propiedades pueden ser utilizadas con propósitos tecnológicos. Un buen ejemplo es la producción de productos a partir de surimi, en los cuales se emplea la capacidad de las proteínas miofibrilares para formar geles. Las proteínas forman un gel muy resistente cuando se añade sal y estabilizadores a una preparación de proteínas musculares (carne finamente picada), que posteriormente se somete a un proceso de calentamiento y enfriamiento controlado (Suzuki, 1981).
Figura 4.4 Solubilidad de las proteínas miofibrilares antes y después del congelado por sublimación a valores de pH en un rango de 2 a 12 (Spinelli et al., 1972)
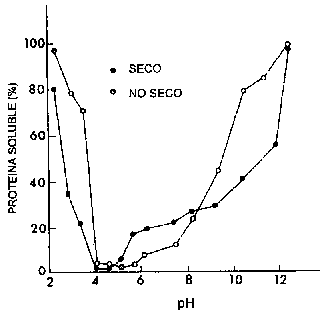
La mayor parte de las proteínas sarcoplasmáticas son enzimas que participan en el metabolismo celular, como en el caso de la conversión de energía anaeróbica del glucógeno a ATP. Si los organelos dentro de las células musculares se rompen, pueden también estar presentes en la fracción proteica las enzimas metabólicas localizadas dentro del retículo endoplasmático, las mitocondrias y los lisosomas.
Cuando los organelos se rompen, ocurren cambios en la composición de la fracción de proteínas sarcoplasmáticas. Este hecho fue sugerido como método para diferenciar pescado fresco de pescado congelado, asumiendo que los organelos estaban intactos hasta la congelación (Rehbein et al., 1978; Rehbein, 1979; Salfi et al., 1985). Sin embargo, posteriormente se estableció que estos métodos deben ser empleados con gran precaución, dado que algunas enzimas son liberadas de los organelos incluso durante el almacenamiento del pescado en hielo (Rehbein, 1992).
Las proteínas de la fracción sarcoplasmática están muy bien adaptadas y permiten distinguir entre diferentes especies de peces, dado que las diferentes especies tienen su patrón de banda característico cuando son separadas mediante el método de enfoque isoeléctrico. El método fue introducido satisfactoriamente por Lundstrom (1980) y ha sido usado por muchos laboratorios y en muchas especies de pescados. La literatura relacionada ha sido revisada por Rehbein (1990).
Las propiedades químicas y físicas de las proteínas de colágeno difieren según el tipo de tejido como la piel, vejiga natatoria y los miocomatas del músculo (Mohr, 1971). En general, las fibras de colágeno forman una delicada estructura de redes, de complejidad variable, según los diferentes tipos de tejido conectivo, siguiendo un patrón similar al encontrado en mamíferos. Sin embargo, el colágeno en peces es mucho más termolábil y contiene menos pero más lábiles entrecruzamientos que el colágeno presente en los vertebrados de sangre caliente. El contenido de hidroxiprolina es en general menor en peces que en mamíferos, aunque se ha observado una variación total del colágeno entre 4.7 y 10 por ciento (Sato et al., 1989).
Diferentes especies contienen diversas cantidades de colágeno en sus tejidos corporales. Esto ha llevado a una teoría: la distribución del colágeno puede reflejar el comportamiento natatorio de las especies (Yoshinaka et al., 1988). Más aún, las diversas cantidades y los diferentes tipo de colágeno en diferentes peces pueden de igual forma tener una influencia en las propiedades texturales del músculo del pez (Montero y Borderías, 1989). Borresen (1976) desarrolló un método para el aislamiento de la red de colágeno que rodea cada célula muscular. La estructura y composición de estas estructuras ha sido caracterizada posteriormente en bacalao por Almaas (1982).
El papel del colágeno en peces ha sido revisado por Sikorsky et al., (1984). Una excelente revisión es suministrada por Bremner (1992), en la cual presenta la más reciente literatura sobre los diferentes tipos de colágeno encontrados en pescado.
Las proteínas del pescado contienen todos los aminoácidos esenciales y al igual que las proteínas de la leche, los huevos y la carne de mamíferos, tienen un valor biológico muy alto (Cuadro 4.3).
Cuadro 4.3 Aminoácidos esenciales (porcentaje) de varias proteínas
|
Aminoácido |
Pescado |
Leche |
Carne vacuna |
Huevos |
|
Lisina |
8,8 |
8,1 |
9,3 |
6,8 |
|
Triptófano |
1,0 |
1,6 |
1,1 |
1,9 |
|
Histidina |
2,0 |
2,6 |
3,8 |
2,2 |
|
Fenilalanina |
3,9 |
5,3 |
4,5 |
5,4 |
|
Leucina |
8,4 |
10,2 |
8,2 |
8,4 |
|
Isoleucina |
6,0 |
7,2 |
5,2 |
7,1 |
|
Treonina |
4,6 |
4,4 |
4,2 |
5,5 |
|
Metionina-cisteína |
4,0 |
4,3 |
2,9 |
3,3 |
|
Valina |
6,0 |
7,6 |
5,0 |
8,1 |
FUENTES: Braekkan, 1976; Moustard, 1957
Los granos de cereales tienen generalmente bajo contenido de lisina y/o aminoácidos que contienen azufre (metionina y cisteína), mientras que el pescado resulta una excelente fuente de estos aminoácidos. En regímenes alimenticios basados principalmente en cereales, un suplemento de pescado puede aumentar significativamente el valor biológico.
Además de las proteínas del pescado mencionadas anteriormente, existe un renovado interés en fracciones proteicas específicas que pueden ser recuperadas de subproductos, particularmente en las vísceras. Uno de estos ejemplos es la proteína básica o protamina encontrada en la lecha del pez macho. El peso molecular es generalmente inferior a 10.000 kD y el pI es mayor de 10. Este es el resultado de la composición extrema de aminoácidos, que puede presentar hasta un 65 por ciento de arginina.
La presencia de las proteínas básicas se conoce desde hace tiempo, sabiéndose también que no están presentes en todas las especies de peces (Kossel, 1928). La mejor fuente son los salmónidos y los arenques, considerando que las protaminas no han sido detectadas en peces como el bacalao.
El carácter extremadamente básico de las protaminas las hace de interés por diferentes razones. Se adhieren a la mayoría de las proteínas menos básicas. Por lo tanto, tienen el efecto de realzar las propiedades funcionales de otras proteínas en el alimento (Poole et al., 1987; Phillips et al., 1989). Sin embargo, la remoción de todos los lípidos presentes en la lecha resulta un problema en la preparación proteica, dado que, su presencia ocasiona sabores y olores objetables en las concentraciones a ser empleadas en los alimentos.
Otra interesante característica de las proteínas básicas es su habilidad para prevenir el crecimiento de microorganismos (Braekkan y Boge, 1964; Kamal et al., 1986). Este parece ser el uso más promisorio para las proteínas básicas en el futuro.
Los compuestos extractables que contienen nitrógeno pueden definirse como compuestos de naturaleza no proteica, solubles en agua, de bajo peso molecular y que contienen nitrógeno. Esta fracción NNP (nitrógeno no proteico) constituye en los teleósteos entre un 9 y un 18 por ciento del nitrógeno total.
Los principales componentes de esta fracción son: bases volátiles como el amoniaco y el óxido de trimetilamina (OTMA), creatina, aminoácidos libres, nucleótidos y bases purínicas y, en el caso de peces cartilaginosos, urea.
En el Cuadro 4.4 se enumeran algunos de los componentes de la fracción NNP del músculo de varios peces, de aves y de mamíferos.
Cuadro 4.4 Principales diferencias en las sustancias extractables del músculo
|
Compuesto en mg/100g peso neto¹) |
Pescado |
Crustáceos |
Aves de carral |
Músculo de mamífero | |||
|
Bacalao |
Arenque |
Tiburón sp. |
Bogavante |
Músculo de la pata | |||
|
1) Extractables totales |
1.200 |
1.200 |
3.000 |
5.500 |
1.200 |
3.500 | |
|
2) Aminoácidos libres totales |
75 |
300 |
100 |
3.000 |
440 |
350 | |
|
|
Arginina |
<10 |
<10 |
<10 |
750 |
<20 |
<10 |
|
|
Glicina |
20 |
20 |
20 |
100-1.000 |
<20 |
<10 |
|
|
Acido glutámico |
<10 |
<10 |
<10 |
270 |
55 |
36 |
|
|
Histidina |
<1,0 |
86 |
<1,0 |
- |
<10 |
<10 |
|
|
Prolina |
<1,0 |
<1,0 |
<1,0 |
750 |
<10 |
<10 |
|
3) Creatina |
400 |
400 |
300 |
0 |
- |
550 | |
|
4) Betaína |
0 |
0 |
150 |
100 |
- |
- | |
|
5) Oxido de trimetilamina |
350 |
250 |
500-1.000 |
100 |
0 |
0 | |
|
6) Anserina |
150 |
0 |
0 |
0 |
280 |
150 | |
|
7) Carnosina |
0 |
0 |
0 |
0 |
180 |
200 | |
|
8) Urea |
0 |
0 |
2.000 |
- |
- |
35 | |
1) En este cuadro, la unidad hace referencia al peso molecular
total del compuesto
FUENTE: Shewan, 1974.
En la Figura 4.5 se muestra un ejemplo de la distribución de los diferentes componentes de la fracción NNP en peces marinos y de agua dulce. Cabe señalar que la composición varía no sólo entre especies diferentes sino también dentro de la misma especie, dependiendo de la talla, estación del año, muestra de músculo, etc.
Figura 4.5 Distribución del nitrógeno no proteico en el músculo del pez: dos especies marinas con estructura ósea (A,B), un elasmobranquio (C) y una especie de agua dulce (D) (Konosu y Yamaguchi, 1982; Suyama et al., 1977)
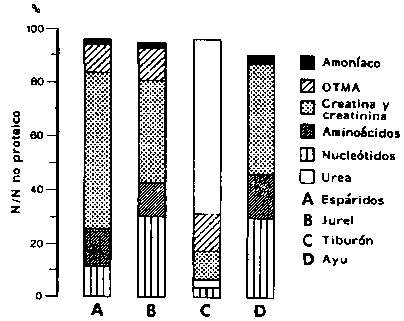
El OTMA constituye una parte característica e importante de la fracción NNP en las especies de agua de mar y merece, por lo tanto, una mención más amplia. Este compuesto se encuentra en todas las especies de peces de agua de mar en cantidades del 1 al 5 por ciento del tejido muscular (peso seco), pero está virtualmente ausente en especies de agua dulce y en organismos terrestres (Anderson y Fellers, 1952; Hebard et al., 1989).
Una excepción fue encontrada recientemente en un estudio sobre la percha del Nilo y la tilapia del Lago Victoria, en las cuales se encontró tanto como 150-200 mg de OTMA/100g de pescado fresco (Gram et al; 1989).
Aunque se han efectuado muchos trabajos sobre el origen y el papel del OTMA, hay todavía mucho por esclarecer. Stroem et al. (1979) han demostrado que el OTMA se forma por biosíntesis de ciertas especies del zooplancton. Estos organismos poseen una enzima (TMA monooxigenasa) que oxida la TMA a OTMA. La TMA comúnmente se encuentra en plantas marinas, al igual que otras aminas metiladas (monometilamina y dimetilamina). El pez que se alimenta de plancton puede obtener OTMA de su alimentación (origen exógeno). Belinski (1964) y Agustsson y Stroem (1981) han demostrado que algunas especies de peces son capaces de sintetizar OTMA a partir de TMA, pero esta síntesis se considera de menor importancia.
El sistema de la TMA-oxidasa se encuentra en los microsomas de las células y es dependiente de la presencia de Dinucleótido de nicotinamida y de adenina fosfato (NADPH):
(CH3)3N + NADPH + H+ + O2 ® (CH3)3NO + NADP+ + H2O
Resulta enigmático que esta monooxigenasa pueda ser encontrada tan extensamente en mamíferos (en los que se cree funciona como desintoxicante), mientras que en la mayoría de los peces la actividad de esta enzima es baja o imperceptible.
Un estudio japonés (kawabata, 1953) señala que hay un sistema OTMA-reductor presente en el músculo de ciertas especies pelágicas.
La cantidad de OTMA en el tejido muscular depende de la especie, estación del año, área de pesca, etc. En general, las mayores cantidades se encuentran en elasmobranquios y calamares (75-250 mg N/100 g), el bacalao tiene algo menos (60-120 mg N/100 g), mientras que los peces planos y pelágicos tienen el mínimo. Una extensa recopilación de datos fue hecha por Hebard et al. (1982). Según Tokunaga (1970), los peces pelágicos (sardinas, atún, caballa) presentan mayor concentración de OTMA en el músculo oscuro mientras que los demersales, peces de carne blanca, tienen más alto contenido en el músculo blanco.
En elasmobranquios, el OTMA parece desempeñar un papel en la osmorregulación y ha sido demostrado que al pasar pequeñas rayas por una mezcla de agua dulce y agua de mar (1:1) se origina una reducción del OTMA intracelular en el orden del 50 por ciento. En los teleósteos el papel del OTMA es más incierto.
Se han propuesto varias hipótesis respecto al papel del OTMA, a saber:
· El OTMA es esencialmente un residuo, la forma desintoxicada de la TMA.· El OTMA es un osmorregulador.
· El OTMA tiene funciones "anticongelantes".
· El OTMA no tiene una función significativa. Se acumula en el músculo cuando el pez ingiere alimentos que contienen OTMA.
Según Stroem (1984), actualmente se acepta el papel osmorregulador del OTMA.
Dado que la presencia del OTMA había sido determinada previamente y virtualmente sólo en especies marinas, hasta las observaciones publicadas por Gram et al. (1989), se especulaba que el OTMA, junto con altas cantidades de taurina, podrían tener efectos adicionales por lo menos en pescados de agua dulce (Anthoni et al., 1990a).
Cuantitativamente, el principal componente de la fracción NNP es la creatina. Cuando el pez está quieto, la mayor parte de la creatina es fosforilada y proporciona energía para la contracción muscular.
La fracción NNP contiene también una cierta cantidad de aminoácidos libres. Estos constituyen en la caballa (Scomber scombrus) 630 mg/100 g de músculo blanco, en el arenque (Clupea harengus) 350-420 mg/100 g y en el capelán (Mallotus villosus) 310-370 mg/100 g. La importancia relativa de los diferentes aminoácidos varía con la especie. En la mayoría de los peces parecen predominar la taurina, alanina, glicina y aminoácidos que contienen imidazol. De estos últimos, la histidina ha concentrado la mayor atención debido a que la misma puede descarboxilarse microbiológicamente a histamina. Especies activas, veloces, con músculo oscuro como el atún y la caballa, tienen un alto contenido de histamina.
La cantidad de nucleótidos y fragmentos de nucleótidos en el pescado muerto depende del estado del pescado, este tema se discute en el Capítulo 5.
La cantidad de vitaminas y minerales es específica de la especie y, además, puede variar con la estación del año. En general, la carne de pescado es una buena fuente de vitamina B y en el caso de las especies grasas, también de vitaminas A y D. Algunas especies de agua dulce, como la carpa, tienen una alta actividad tiaminasa razón por la cual el contendido de tiamina en esta especie es por lo general bajo. Respecto a los minerales, la carne de pescado se considera una fuente particularmente valiosa de calcio y fósforo, así como también de hierro y cobre. Los peces de mar tienen un alto contenido de yodo. En los Cuadros 4.5 y 4.6 se indican los contenidos de algunas vitaminas y minerales. Debido a la variación natural de estos componentes no es posible dar cifras exactas.
Cuadro 4.5 Vitaminas en el pescado
|
Pescado |
A (UI/g) |
D (UI/g) |
B1 (tiamina) (m /g) |
B2 (riboflavina) (m /g) |
Niacina (m /g) |
Acido Pantoténico |
B6 (m /g) |
|
Filete de bacalao |
0-50 |
0 |
0,7 |
0,8 |
20 |
1.7 |
1,7 |
|
Filete de arenque |
20-400 |
300-1000 |
0,4 |
3,0 |
40 |
10 |
4,5 |
|
Aceite de hígado de bacalao |
200-10000 |
20-300 |
- |
1)3,4 |
1)15 |
1) 4,3 |
- |
1) Hígado entero
FUENTE: Murray y Burt, 1969
Cuadro 4.6 Algunos constituyentes minerales del músculo de pescado
|
Elemento |
Valor promedio (mg/100g) |
Rango (mg/100g) |
|
Sodio |
72 |
30 - 134 |
|
Potasio |
278 |
19 - 502 |
|
Calcio |
79 |
19 - 881 |
|
Magnesio |
38 |
4,5 - 452 |
|
Fósforo |
190 |
68 - 550 |
FUENTE: Murray y Burt, 1969
El contenido de vitaminas es comparable con el de los mamíferos excepto en el caso de las vitaminas A y D, que se encuentran en grandes cantidades en la carne de las especies grasas y en abundancia en el hígado de especies como el bacalao y el hipogloso. Debe señalarse que el contenido de sodio en la carne de pescado es relativamente bajo lo cual le hace apropiado para regímenes alimenticios de tal naturaleza.
En los peces de acuicultura, se considera que el contenido de vitaminas y minerales refleja la composición de los constituyentes en el alimento del pez, aunque los datos deben ser interpretados con gran cuidado (Maage et al., 1991). A fin de proteger los ácidos grasos poliinsaturados n-3, considerados de gran importancia tanto para el pez como para la salud humana, debe añadirse vitamina E en el alimento del pez, como antioxidante. Se ha demostrado que el nivel de vitamina E presente en los tejidos del pescado se corresponde con la concentración añadida en el alimento (Waagbo et al., 1991).